Valsartán CAS 137862-53-4 Ensayo 98,0~102,0% Estándar API USP
Ruifu Chemical es el proveedor líder de Valsartán (CAS: 137862-53-4) con alta calidad y puede cumplir con el estándar USP/EP. Ruifu Chemical lleva más de 15 años suministrando API e intermedios farmacéuticos.
Ruifu Chemical puede ofrecer entregas en todo el mundo, precios competitivos y excelente servicio.
Comprar Valsartán y productos intermedios relacionados. por favor contáctenos por correo electrónico: alvin@ruifuchem.com
| Nombre químico | Valsartán |
| Sinónimos | N-Valerilo-N-[2'-(1H-tetrazol-5-il)bifenil-4-ilmetil]-L-valina |
| Número CAS | 137862-53-4 |
| Estado del stock | En stock, la producción aumenta hasta toneladas |
| Fórmula molecular | C24H29N5O3 |
| Peso Molecular | 435.52 |
| Punto de fusión | 116,0 ~ 117,0 ℃ |
| densidad | 1,212±0,06g/cm3 |
| Estabilidad | higroscópico |
| Solubilidad | Soluble en metanol |
| COA y MSDS | Disponible |
| Origen | Shanghái, China |
| Categorías de productos | API (ingrediente farmacéutico activo) |
| Marca | Química Ruifu |
| Artículos de prueba | Especificaciones | Resultados |
| Apariencia | Polvo cristalino de color blanco a casi blanco. | Polvo cristalino blanco |
| Identificación | ||
| IR | Debe cumplir con el estándar de referencia. | Cumple |
| HPLC | Debe cumplir con el estándar de referencia. | Cumple |
| Absorbancia (420 mm) | ≤0,02 % (λ=420 nm, C=0,05 g/ml, L=1 cm) | 0,012% |
| Agua (por K.F) | ≤1,00% | 0,20% |
| Residuo en el encendido | ≤0,10% | 0,06% |
| Metales pesados | ≤0,001% | <0,001% |
| Sustancias relacionadas | ||
| Compuesto A | ≤1,00% | 0,37% |
| Compuesto B | ≤0,20% | 0,02% |
| Compuesto C | ≤0,10% | No detectable |
| Cualquier otra impureza individual | ≤0,10% | 0,02% |
| Impurezas totales | ≤0,30% (Excluyendo R-Isómero) | 0,07% |
| Disolventes residuales (GC) | ||
| Metanol | ≤3000 ppm | 693 ppm |
| Acetato de etilo | ≤5000 ppm | 3013 ppm |
| N,N-Dimetilformamida | ≤880 ppm | No detectable |
| tolueno | ≤890 ppm | 8 ppm |
| Método de ensayo/análisis | 98,0~102,0% (calculado sobre el anhidro Base, Solvente-Base libre) | 99,7% |
| Estándar de prueba | USP 37 | Cumple |
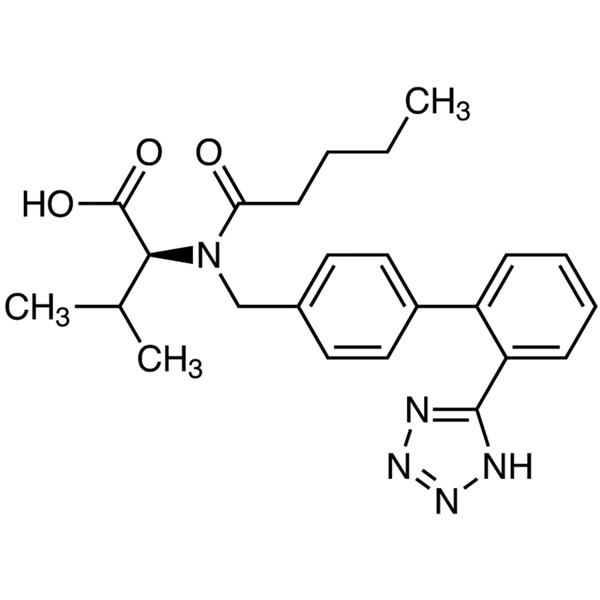
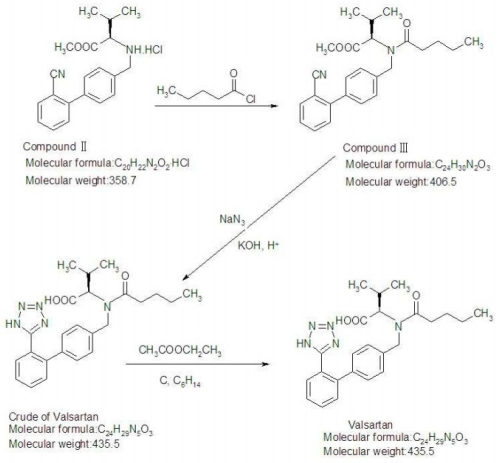
Valsartán
C24H29N5O3 435,52
l-Valina, N-(1-oxopentil)-N-[[2'-(1H-tetrazol-5-il)[1,1'-bifenil]-4-il]metil]-.
N-[p-(o-1H-Tetrazol-5-ilfenil)bencil]-N-valeril-l-valina [137862-53-4].
Valsartán contiene no menos del 98,0 por ciento y no más del 102,0 por ciento de C24H29N5O3, calculado en base anhidra.
Envasado y almacenamiento-Conservar en recipientes herméticos, y almacenar a 25ºC, temperaturas permitidas entre 15 y 30ºC. Proteger de la humedad y el calor.
Estándares de referencia USP<11>-
Valsartán RS USP
ER Compuesto Relacionado A Valsartán USP
(R-N-Valeril-N-([2'-(1H-tetrazol-5-il)bifen-4-il]metil)valina.
C24H29N5O3 435,52
ER Compuesto Relacionado B de Valsartán USP
(S-N-Butiril-N-([2'-(1H-tetrazol-5-il)bifen-4-il]metil)-valina.
C23H27N5O3 421,49
ER Compuesto Relacionado C de Valsartán USP
(S-N-Valeril-N-([2'-(1H-tetrazol-5-il)bifen-4-il]metil)-valina éster bencílico.
C31H35N5O3 525,64
Identificación-
R: Absorción de infrarrojos <197 M>.
B: El tiempo de retención del pico principal en el cromatograma de la Preparación de ensayo corresponde al del cromatograma de la Preparación estándar, tal como se obtiene en el Ensayo.
Absorbancia-Preparar una solución 1 en 20 en metanol y determinar la absorbancia a 420 nm. La absorbancia dividida por la longitud del camino no es superior a 0,02.
Agua, Método I<921>: no más del 2,0%.
Residuo por ignición<281>: no más del 0,1%.
Metales pesados, Método II<231>: 0,001%.
Compuestos relacionados-
Prueba 1 (límite del compuesto relacionado a de valsartán)-
Fase móvil-Preparar una mezcla de n-hexano, 2-propanol y ácido trifluoroacético (85:15:0,1). Realice ajustes si es necesario (consulte Idoneidad del sistema en Cromatografía 621).
Solución estándar-Disolver una cantidad pesada con precisión de ER Compuesto Relacionado A de Valsartán USP en Fase móvil y diluir cuantitativamente, y paso a paso si es necesario, para obtener una solución que tenga una concentración conocida de aproximadamente 0,01 mg por ml.
Solución de idoneidad del sistema-Disolver cantidades pesadas con precisión de ER Valsartán USP y ER Compuesto Relacionado A de Valsartán USP en fase móvil para obtener una solución que tenga concentraciones conocidas de aproximadamente 0,04 mg por ml de valsartán y de compuesto relacionado A de valsartán.
Solución de prueba - Transfiera aproximadamente 50 mg de Valsartán, pesados con precisión, a un matraz volumétrico de 50 - ml, agregue aproximadamente 40 ml de fase móvil y someta a ultrasonidos durante 5 minutos. Diluir a volumen con Fase móvil y mezclar.
Sistema cromatográfico (ver Cromatografía<621>)-El cromatógrafo líquido está equipado con un detector de 230-nm y una columna de 4,6-mm × 25-cm que contiene un relleno L40 de 5-μm. El caudal es de aproximadamente 0,8 ml por minuto. Cromatografíe la solución de idoneidad del sistema y registre las respuestas de los picos según se indica en el Procedimiento: la resolución, R, entre el compuesto relacionado A de valsartán y valsartán no es inferior a 2,0; y la desviación estándar relativa, determinada a partir del pico del compuesto relacionado A de valsartán, para inyecciones repetidas no es superior al 5 %.
Procedimiento-Inyecte por separado volúmenes iguales (aproximadamente 10 µL) de la Solución estándar y la Solución de prueba en el cromatógrafo, registre los cromatogramas y mida las áreas de los picos principales. Calcule el porcentaje del compuesto relacionado A de valsartán en la porción de valsartán tomada mediante la fórmula:
100(CS/CU)(rU/rS)
en la que CS es la concentración, en mg por ml, de ER Compuesto Relacionado A de Valsartán USP en la Solución estándar; CU es la concentración, en mg por ml, de valsartán en la solución problema; y rU y rS son las respuestas de los picos para el compuesto relacionado A de valsartán obtenidos de la Solución de prueba y la Solución estándar, respectivamente: no se encuentra más del 1,0%.
prueba 2 (límite del compuesto relacionado b de valsartán, del compuesto relacionado c de valsartán y de otros compuestos relacionados)-
Fase móvil-Proceder según se indica en el Ensayo.
Solución estándar-Disolver cantidades pesadas con precisión de ER Valsartán USP, ER Compuesto Relacionado B de Valsartán USP y ER Compuesto Relacionado C de Valsartán USP en la fase móvil y diluir cuantitativamente, y por pasos si es necesario, con la Fase móvil para obtener una solución que tenga concentraciones conocidas de aproximadamente 0,001 mg de valsartán por ml, 0,001 mg de compuesto relacionado B de valsartán por ml y 0,001 mg de compuesto relacionado C de valsartán por ml.
Solución de prueba-Transferir aproximadamente 50 mg de Valsartán, pesados con precisión, a un matraz volumétrico de 100-mL, disolver y diluir con Fase móvil a volumen y mezclar.
Sistema cromatográfico (consulte Cromatografía<621>)-Prepárese según se indica en el Análisis, excepto para usar un detector de 225-nm. Cromatografía la Solución estándar y registra las respuestas de los picos según se indica en el Procedimiento: la resolución, R, entre el compuesto relacionado B de valsartán y valsartán no es inferior a 1,8; la desviación estándar relativa, determinada a partir de los picos del compuesto relacionado B de valsartán, para inyecciones repetidas no es superior al 10,0 %; y la desviación estándar relativa, determinada a partir de los picos de valsartán, para inyecciones repetidas no es superior al 2,0%.
Procedimiento-Inyecte por separado volúmenes iguales (aproximadamente 10 µL) de la Solución estándar y la Solución de prueba en el cromatógrafo, registre los cromatogramas y mida las áreas de los picos principales. Calcule el porcentaje de compuesto relacionado B de valsartán y compuesto relacionado C de valsartán en la porción de valsartán tomada por la fórmula:
100(CS/CU)(ri/rS)
en la que CS es la concentración, en mg por ml, del ER Compuesto Relacionado de Valsartán USP apropiado en la Solución estándar; CU es la concentración, en mg por ml, de valsartán en la solución problema; ri es la respuesta máxima de la impureza obtenida de la solución de prueba; y rS es la respuesta máxima para el compuesto relacionado de valsartán apropiado obtenido de la Solución estándar. Calcular el porcentaje de cada una de las impurezas en la porción de Valsartán tomada mediante la misma fórmula, en la que CS es la concentración, en mg por ml, de ER Valsartán USP en la Solución estándar; rS es la respuesta máxima de valsartán obtenida a partir de la Solución estándar; y los demás términos son como se definen anteriormente: no se encuentra más del 0,2% del compuesto relacionado B de valsartán; no se encuentra más del 0,1% del compuesto relacionado C de valsartán; no se encuentra más del 0,1% de cualquier otra impureza individual, excluyendo el compuesto relacionado A de valsartán; y no se encuentra más del 0,3% del total de impurezas, excluyendo el compuesto relacionado A de valsartán.
Ensayo-
Fase móvil-Preparar una mezcla filtrada y desgasificada de agua, acetonitrilo y ácido acético glacial (500:500:1). Realice ajustes si es necesario (consulte Idoneidad del sistema en Cromatografía 621).
Preparación estándar-Disolver una cantidad pesada con precisión de Valsartán RS USP en Fase móvil y diluir cuantitativamente, y gradualmente si es necesario, con Fase móvil para obtener una solución que tenga una concentración conocida de aproximadamente 0,5 mg por ml.
Preparación del ensayo-Transferir aproximadamente 50 mg de Valsartán, pesados con precisión, a un matraz volumétrico de 100-mL, disolver y diluir con Fase móvil a volumen y mezclar.
Sistema cromatográfico (consulte Cromatografía<621>)-El cromatógrafo líquido está equipado con un detector de 273 nm y una columna de 3,0 mm × 12,5 cm que contiene un relleno L1 de 5 µm. El caudal es de aproximadamente 0,4 ml por minuto. Cromatografía la preparación estándar y registra las respuestas máximas como se indica en el Procedimiento: la desviación estándar relativa para inyecciones repetidas no es superior al 2,0 %.
Procedimiento-Inyecte por separado volúmenes iguales (aproximadamente 10 µL) de la preparación estándar y de la preparación de ensayo en el cromatógrafo, registre los cromatogramas y mida las áreas de los picos principales. Calcule la cantidad, en mg, de C24H29N5O3 en la porción de Valsartán tomada mediante la fórmula:
100C(ru/rS)
donde C es la concentración, en mg por ml, de ER Valsartán USP en la Preparación estándar; y rU y rS son las respuestas máximas obtenidas de la preparación de ensayo y la preparación estándar, respectivamente.
Paquete: Botella, bolsa de papel de aluminio, tambor de cartón de 25 kg o según los requisitos del cliente.
Condición de almacenamiento: Mantenga el recipiente bien cerrado y guárdelo en un lugar fresco, seco (2 ~ 8 ℃) y bien ventilado, lejos de sustancias incompatibles. Proteger de la luz y la humedad.
Envío: Entrega a todo el mundo por vía aérea, por FedEx / DHL Express. Proporcionar una entrega rápida y confiable.

Símbolos de peligro Xi - irritante
Códigos de riesgo
36/37/38 - Irrita los ojos, el sistema respiratorio y la piel.
Descripción de seguridad
S26 - En caso de contacto con los ojos, enjuagar inmediatamente con abundante agua y consultar a un médico.
S37/39 - Úsense guantes adecuados y protección para los ojos y la cara.
WGK Alemania 3
RTECS YV9455000
Código SA 2933990099
Shanghai Ruifu Chemical Co., Ltd. es el fabricante y proveedor líder de Valsartán (CAS: 137862-53-4) de alta calidad. Valsartán es un antagonista no peptídico del receptor AT1 de angiotensina II, antihipertensivo, tiene potencial para la investigación de la presión arterial alta y la insuficiencia cardíaca.
Los efectos antihipertensivos de Valsartán son más potentes que los del enalapril y es adecuado para tratar la hipertensión, la hipertensión primaria de leve a moderada y, especialmente, la hipertensión secundaria causada por daño renal. Puede reducir significativamente la proteinuria en pacientes hipertensos con diabetes o funciones hepáticas normales, y puede promover el ácido úrico y el sodio urinario para proteger el riñón. Valsartán también es adecuado para reducir la mortalidad cardiovascular en pacientes de alto riesgo (insuficiencia o disfunción ventricular izquierda) después de sufrir un infarto.