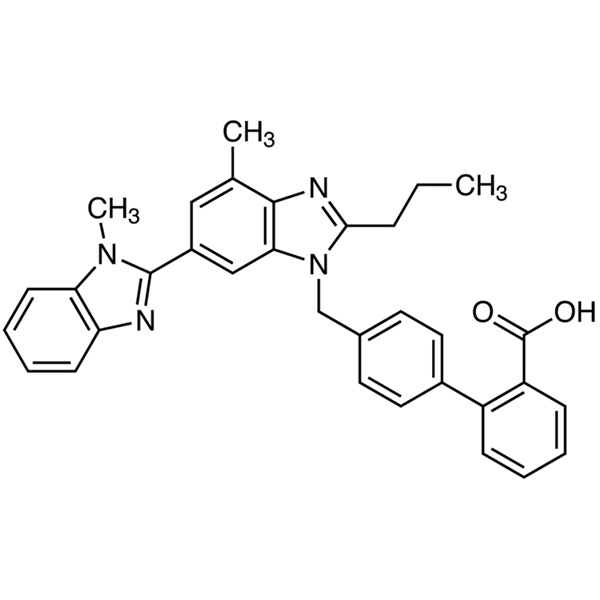
Telmisartan CAS 144701-48-4 Ensayo 99,0%~101,0% API EP Estándar de alta calidad
Shanghai Ruifu Chemical Co., Ltd. es el proveedor líder de Telmisartan (CAS: 144701-48-4) con alta calidad y puede cumplir con el estándar USP/EP. DMF/ CEP/ GMP disponibles.
Ruifu Chemical lleva más de 15 años suministrando API e intermedios farmacéuticos.
Ruifu Chemical puede ofrecer entregas en todo el mundo, precios competitivos y excelente servicio.
Para comprar Telmisartán y productos intermedios relacionados, comuníquese con nosotros por correo electrónico:alvin@ruifuchem.com
| Nombre químico | Telmisartán |
| Sinónimos | 4'-[[4-Metil-6-(1-Metil-1H-Benzimidazol-2-il)-2-Propil-1H-Benzimidazol-1-il]metil]bifenil-2-Ácido carboxílico; 4'-[(1,4'-Dimetil-2'-propil[2,6'-bi-1H-Benzimidazol]-1'-il)metil]-[1,1'-Bifenil]-2-Ácido carboxílico |
| Número CAS | 144701-48-4 |
| Estado del stock | En stock, la producción aumenta hasta toneladas |
| Fórmula molecular | C33H30N4O2 |
| Peso Molecular | 514.63 |
| Punto de fusión | 261,0 ~ 263,0 ℃ |
| Solubilidad en agua | insoluble |
| Estabilidad | higroscópico |
| Condición de almacenamiento | 2-8℃ |
| COA y MSDS | Disponible |
| Origen del producto | Shanghái, China |
| Categorías de productos | API (ingrediente farmacéutico activo) |
| Marca | Química Ruifu |
| Artículos | Especificaciones | Resultados |
| Apariencia | Polvo cristalino blanco o ligeramente amarillento | Polvo cristalino blanco |
| Solubilidad | Debe cumplir con el requisito | Cumple |
| Identificación por infrarrojos | Debe corresponder a la absorción de infrarrojos RS | Cumple |
| Aparición de la solución | Debe cumplir con el requisito | Cumple |
| Sustancias relacionadas | ||
| Impureza A | ≤0,15% | 0,05% |
| Impureza B | ≤0,15% | 0,02% |
| Impureza C | ≤0,20% | 0,03% |
| Impureza D | ≤0,20% | 0,05% |
| Impurezas no especificadas: | ≤0,10% | 0,06% |
| Impurezas totales | ≤1,00% | 0,30% |
| Solventes residuales | ||
| Metanol | ≤0,30% | No detectado |
| etanol | ≤0,50% | 0,031% |
| dicloruro de metileno | ≤0,06% | No detectado |
| n-hexano | ≤0,029% | No detectado |
| Éster etílico del ácido acético | ≤0,50% | No detectado |
| tolueno | ≤0,089% | 0,025% |
| Ácido acético | ≤0,50% | 0,036% |
| Pérdida por secado | ≤0,50% | 0,20% |
| Ceniza Sulfatada | ≤0,10% | Cumple |
| Punto de fusión | 261,0 ~ 263,0 ℃ | 261,5 ~ 262,1 ℃ |
| Tamaño de partícula | 90% Menos de 200μm | Cumple |
| Ensayo | 99,0%~101,0% (sustancia seca) | 99,9% |
| Estándar de prueba | Cumple con la Farmacopea Europea 7.0 | Cumple |
Paquete: Botella, bolsa de papel de aluminio, 25 kg/tambor de cartón, o según requerimiento del cliente.
Condición de almacenamiento: Mantener el recipiente bien cerrado. Almacenar en un lugar fresco, seco (2-8℃) y bien ventilado, lejos de sustancias incompatibles. Mantener alejado de la luz del sol; evitar el fuego y las fuentes de calor; evitar la humedad.
Envío: Entrega a todo el mundo por aire, mar, por FedEx / DHL Express. Proporcionar una entrega rápida y confiable.

Símbolos de peligro Xi - irritante
Códigos de Riesgo 36/37/38 - Irrita los ojos, el sistema respiratorio y la piel.
Descripción de seguridad S22 - No respirar el polvo.
S24/25 - Evite el contacto con la piel y los ojos.
S36 - Utilice ropa protectora adecuada.
S26 - En caso de contacto con los ojos, enjuagar inmediatamente con abundante agua y consultar a un médico.
WGK Alemania 2
RTECS DV2037500
Código SA 2933990099
Telmisartán (CAS: 144701-48-4) es un derivado de bencimidazol y un antagonista no peptídico del receptor de angiotensina II con propiedades antihipertensivas. Telmisartán antagoniza selectivamente la unión de la angiotensina II al receptor del subtipo AT1, ubicado en el músculo liso vascular y la glándula suprarrenal. El antagonismo produce vasodilatación e inhibe la producción de aldosterona mediada por angiotensina II, lo que a su vez conduce a una disminución de sodio y agua, así como a un aumento de la excreción de potasio que conduce a una reducción posterior de la presión arterial. Telmisartán es un nuevo tipo de medicamento para la presión arterial, se usa solo o en combinación con otras clases de antihipertensivos para el tratamiento de la hipertensión. Telmisartán fue formulado originalmente por la empresa farmacéutica alemana Boehringer Ingelheim; Obtuvo la patente alemana EP502,314 en 1991, fue aprobado por primera vez para ingresar al mercado estadounidense en noviembre de 1998 y luego ingresó a los mercados alemán, filipino, australiano, belga, británico y otros.
C33H30N4O2
señor 514.6
[144701-48-4]
DEFINICIÓN
Ácido 4′-[[4-Metil-6-(1-metil-1H-bencimidazol-2-il)-2-propil-1H-bencimidazol-1-il]metil][1,1′-bifenil]-2-carboxílico.
Contenido: 99,0 por ciento a 101,0 por ciento (sustancia seca).
PERSONAJES
Aspecto: polvo cristalino de color blanco o ligeramente amarillento.
Solubilidad: prácticamente insoluble en agua, ligeramente soluble en metanol, escasamente soluble en cloruro de metileno. Se disuelve en una solución de 40 g/L de hidróxido de sodio R.
Muestra polimorfismo (5.9).
IDENTIFICACIÓN
Espectrofotometría de absorción infrarroja (2.2.24).
Comparación: Telmisartán CRS.
Si los espectros obtenidos en estado sólido muestran diferencias, disolver la sustancia a examinar y la sustancia de referencia por separado en etanol anhidro R caliente, evaporar hasta sequedad y registrar nuevos espectros utilizando los residuos.
PRUEBAS
Aspecto de la solución. La solución no tiene un color más intenso que la solución de referencia Y4 (2.2.2, Método II).
Disolver 0,5 g en una solución de 40 g/L de hidróxido de sodio R y diluir a 10 ml con el mismo disolvente.
Sustancias relacionadas. Cromatografía líquida (2.2.29).
Solución de prueba. A 25 mg de la sustancia a examinar, agregue aproximadamente 5 mL de metanol R y 100 μL de una solución de 40 g/L de hidróxido de sodio R. Disolver mediante sonicación y diluir a 50,0 mL con metanol R.
Solución de referencia (a). Diluir 1,0 ml de la solución de prueba a 10,0 ml con metanol R. Diluir 1,0 ml de esta solución a 100,0 ml con metanol R.
Solución de referencia (b). Disolver el contenido de un vial de telmisartán para la idoneidad del sistema CRS (que contiene impurezas A, B, C, E y F) en 2 ml de metanol R.
Solución de referencia (c). A 5 mg de telmisartán para la identificación del pico CRS (que contiene la impureza D), agregue aproximadamente 5 ml de metanol R y 100 μL de una solución de 40 g/L de hidróxido de sodio R. Disolver mediante sonicación y diluir a 10 ml con metanol R.
Columna:
– tamaño: l = 0,125 m, Ø = 4,0 mm;
– fase estacionaria: gel de sílice octadecilsililo terminal para cromatografía R (5 μm) con un tamaño de poro de 10 nm;
– temperatura: 40 °C.
Fase móvil:
– fase móvil A: disolver 2,0 g de dihidrogenofosfato de potasio R y 3,8 g de pentanosulfonato de sodio monohidrato R1 en 900 ml de agua para cromatografía R, ajustar a pH 3,0 con ácido fosfórico diluido R y diluir a
1000 mL con agua para cromatografía R;
– fase móvil B: metanol R1, acetonitrilo para cromatografía R (20:80 V/V);
Tiempo (min) Fase móvil A (porcentaje V/V) Fase móvil B (porcentaje V/V)
0 - 3 70 30
3 - 28 70 → 20 30 → 80
Caudal: 1 ml/min.
Detección: espectrofotómetro a 230 nm.
Inyección: 10 μL.
Identificación de impurezas: utilice el cromatograma suministrado con telmisartán para determinar la idoneidad del sistema CRS y el cromatograma obtenido con la solución de referencia (b) para identificar los picos debidos a las impurezas A, B, C, E y F;
utilice el cromatograma suministrado con telmisartán para la identificación del pico CRS y el cromatograma obtenido con la solución de referencia (c) para identificar el pico debido a la impureza D.
Retención relativa con referencia a telmisartán
(tiempo de retención = aproximadamente 15 min): impureza A = aproximadamente 0,2;
impureza E = aproximadamente 0,6; impureza F = aproximadamente 0,7;
impureza B = aproximadamente 0,9; impureza C = aproximadamente 1,5;
impureza D = aproximadamente 1,6.
Idoneidad del sistema: solución de referencia (b):
– el cromatograma obtenido con la solución de referencia (b) es similar al cromatograma suministrado con telmisartán para determinar la idoneidad del sistema CRS;
– resolución: mínimo 3,0 entre los picos debido a la impureza B y telmisartán.
Límites:
– impurezas C, D: para cada impureza, no más del doble del área del pico principal en el cromatograma obtenido con la solución de referencia (a) (0,2 %);
– impurezas A, B: para cada impureza, no más de 1,5 veces el área del pico principal en el cromatograma obtenido con la solución de referencia (a) (0,15 %);
– impurezas no especificadas: para cada impureza, no más que el área del pico principal en el cromatograma obtenido con la solución de referencia (a) (0,10 %);
– total: no más de 10 veces el área del pico principal en el cromatograma obtenido con la solución de referencia (a) (1,0 %).
– límite de desprecio: 0,5 veces el área del pico principal en el cromatograma obtenido con la solución de referencia (a) (0,05 %).
Pérdida por desecación (2.2.32): máximo 0,5 por ciento, determinada en 1.000 g por secado en estufa a 105 ℃.
Cenizas sulfatadas (2.4.14): máximo 0,1 por ciento, determinado sobre 1,0 g.
ENSAYO
Disolver 0,190 g en 5 mL de ácido fórmico anhidro R. Agregar 75 mL de anhídrido acético R. Titular con ácido perclórico 0,1 M, determinando el punto final potenciométricamente (2.2.20).
1 mL de ácido perclórico 0,1 M equivale a 25,73 mg de C33H30N4O2.
IMPUREZAS
Impurezas especificadas: A, B, C, D.
Otras impurezas detectables (las siguientes sustancias, si estuvieran presentes en un nivel suficiente, se detectarían mediante una u otra de las pruebas de la monografía. Están limitadas por el criterio de aceptación general para otras impurezas/no especificadas y/o por la monografía general Sustancias para uso farmacéutico (2034). Por lo tanto, no es necesario identificar estas impurezas para demostrar el cumplimiento. Véase también 5.10. Control de impurezas en sustancias para uso farmacéutico): E, F, G, H, I, J.
A. 4-metil-6-(1-metil-1H-bencimidazol-2-il)-2-propil-1H-bencimidazol,
B. ácido 4′-[[7-metil-5-(1-metil-1H-bencimidazol-2-il)-2-propil-1H-bencimidazol-1-il]metil][1,1′-bifenil]-2-ácido carboxílico,
C. terc-butilo 4′-[[4-metil-6-(1-metil-1H-bencimidazol-2-il)-2-propil-1H-bencimidazol-1-il]metilo][1,1′-bifenil]-2-carboxilato,
D. estructura desconocida,
E. 1-[(2′-carboxi[1,1′-bifenil]-4-il)metil]-4-metil-2-propil-1H-bencimidazol-6-ácido carboxílico,
F. 4′-[[4-metil-6-(1-metil-1H-bencimidazol-2-il)-2-propil-1H-bencimidazol-1-il]metil][1,1′-bifenil]-2-carboxamida,
G. 4′-[[4-metil-6-(1-metil-1H-bencimidazol-2-il)-2-propil-1H-bencimidazol-1-il]metil][1,1′-bifenil]-2-carbonitrilo,
H. 4′-(bromometil)[1,1′-bifenil]-2-carboxilato de terc-butilo,
I. 4′-[(1,7′-dimetil-2′-propil-1H,3′H-[2,5′-bibencimidazol]-3′-il)metil][1,1′-bifenil]-2-carboxilato de metilo,
J. Ácido 4′-[(5-cloro-1,7′-dimetil-2′-propil-1H,3′H-[2,5′-bibencimidazol]-3′-il)metil][1,1′-bifenil]-2-carboxílico.