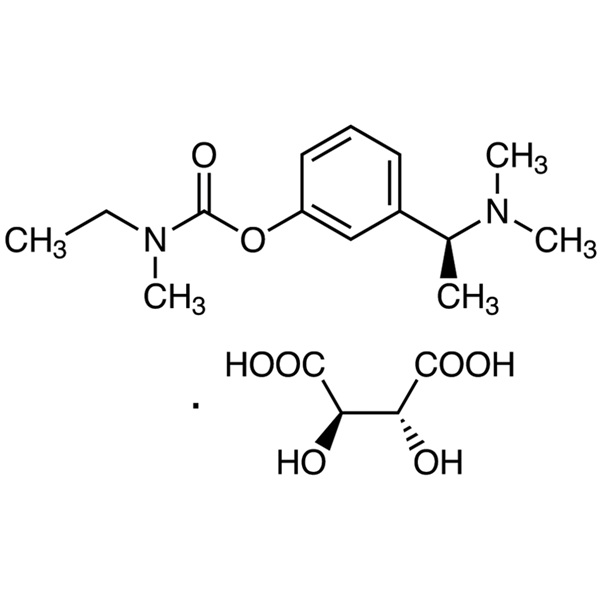
Tartrato de rivastigmina CAS 129101-54-8 Ensayo 98,0~102,0
Shanghai Ruifu Chemical Co., Ltd. es el fabricante líder de tartrato de rivastigmina (CAS: 129101-54-8) de alta calidad. Ruifu Chemical puede ofrecer entregas en todo el mundo, precios competitivos, excelente servicio y cantidades pequeñas y al por mayor disponibles. Comprar tartrato de rivastigmina, Por favor contacte: alvin@ruifuchem.com
| Nombre químico | Tartrato de rivastigmina |
| Sinónimos | Exelón; ENA-713; Rivastigmina L-Tartrato; tartrato de hidrógeno de rivastigmina; CS-118; S-Tartrato de rivastigmina; 3-[(S)-1-(Dimetilamino)etil]fenilo N-Etil-N-Metilcarbamato L-Tartrato; N-Etil-N-Ácido metilcarbámico 3-[(S)-1-(Dimetilamino)etil]fenil éster L-Tartrato |
| Estado del stock | En stock, producción comercial |
| Número CAS | 129101-54-8 |
| CAS relacionados | 123441-03-2 |
| Fórmula molecular | C14H22N2O2·C4H6O6 |
| Peso Molecular | 400,43 g/mol |
| Punto de fusión | 124,0 a 128,0 ℃ |
| Rotación específica [a]20/D | +4,0° a +7,0° (C=5, metanol) |
| Solubilidad | Soluble en metanol |
| COA y MSDS | Disponible |
| Origen | Shanghái, China |
| Marca | Química Ruifu |
| Artículos | Estándares de inspección | Resultados |
| Apariencia | Blanco a blanquecino - Polvo cristalino | Cumple |
| Ensayo | 98,0~102,0% (en base anhidra) | 99,8% |
| Agua de Karl Fischer | ≤0,50% | 0,15% |
| Residuo en el encendido | ≤0,10% | 0,07% |
| Metales pesados (Pb) | ≤20 ppm | <10 ppm |
| Impureza de fenol | ≤0,30% | <0,30% |
| DPTTA | ≤0,15% | <0,15% |
| Ni impureza | ≤0,15% | <0,15% |
| Impureza de carbamato | ≤0,15% | <0,15% |
| Impureza de éter | ≤0,15% | <0,15% |
| Cualquier otra impureza | ≤0,10% | <0,10% |
| Impurezas totales | ≤0,50% | <0,50% |
| R-Enantiómero | ≤0,30% | <0,30% |
| Espectro infrarrojo | Consistente con la estructura | Cumple |
| Espectro de RMN 1H | Consistente con la estructura | Cumple |
| Conclusión | El producto ha sido probado y cumple con la norma USP35. | |
Paquete: Botella de Fluorado, Bolsa de papel de aluminio, 25kg/Bidón de Cartón, o según requerimiento del cliente.
Condición de almacenamiento: Mantenga el recipiente bien cerrado y guárdelo en un lugar fresco, seco (2 ~ 8 ℃) y bien ventilado, lejos de sustancias incompatibles. Proteger de la luz y la humedad.
Envío:Entrega a todo el mundo por vía aérea, por FedEx / DHL Express. Proporcionar una entrega rápida y confiable.
Tartrato de rivastigmina
C14H22N2O2·C4H6O6 400,42
Ácido etilmetilcarbámico, éster 3-[(S)-1-(dimetilamino)etil]fenílico, (2R,3R)-2,3-dihidroxibutanodioato;
(S)-3-[1-(Dimetilamino)etil]feniletilmetilcarbamato, tartrato de hidrógeno [129101-54-8].
Rivastigmina 250,34 [123441-03-2].
DEFINICIÓN
El tartrato de rivastigmina contiene no menos de 98,0% y no más de 102,0% de la cantidad declarada de C14H22N2O2·C4H6O6, calculada en base anhidra.
IDENTIFICACIÓN
• A. Absorción de infrarrojos<197K>
• B. El tiempo de retención del pico mayor de la Solución muestra corresponde al de la Solución de idoneidad del Sistema, según se obtuvo en la prueba de Impurezas Orgánicas, Procedimiento 2: Pureza Enantiomérica.
ENSAYO
• Procedimiento
Tampón: 8,6 mg/mL de fosfato monobásico de amonio. Ajustar con solución de amoniaco a un pH de 7,0.
Fase móvil: Metanol, acetonitrilo y Tampón (15:15:70)
Solución de idoneidad del sistema: 0,05 mg/mL de ER Compuesto Relacionado A de Rivastigmina USP y ER Compuesto Relacionado B de Rivastigmina USP en fase móvil
Solución estándar: 0,2 mg/mL de ER Tartrato de Rivastigmina USP en Fase móvil
Solución muestra: 0,2 mg/mL de Tartrato de rivastigmina en Fase móvil
sistema cromatográfico
(Consulte Cromatografía<621>, Idoneidad del sistema).
Modo: LC
Detector: UV 215 nm
Columna: 4,6-mm × 25-cm; 5-μm empaquetadura L7
Caudal: 1,2 ml/min
Tamaño de la inyección: 20 µL
[Nota-El caudal se puede ajustar a 1,5 ml/min, si es necesario, para lograr el tiempo de retención recomendado de rivastigmina de aproximadamente 10 minutos. ]
Idoneidad del sistema
Muestras: Solución de idoneidad del sistema y Solución estándar
Requisitos de idoneidad
Resolución: No menos de 1,5 entre el compuesto relacionado A de rivastigmina y el compuesto relacionado B de rivastigmina, Solución de idoneidad del sistema
Eficiencia de la columna: No menos de 5000 platos teóricos, Solución estándar
Factor de cola: NMT 3.0, solución estándar
Desviación estándar relativa: No más de 2,0%, Solución estándar
Análisis
Muestras: Solución estándar y Solución muestra
Calcular el porcentaje de C14H22N2O2·C4H6O6 en la porción de tartrato de rivastigmina tomada:
Resultado = (rU/rS) × (CS/CU) × 100
rU = respuesta máxima de la Solución muestra
rS = respuesta máxima de la Solución estándar
CS = concentración de la Solución estándar (mg/mL)
CU = concentración de la Solución muestra (mg/mL)
Criterios de aceptación: 98,0%-102,0% en base anhidra
IMPUREZAS
Impurezas inorgánicas
• Residuo en la ignición<281>: No más de 0,1%
• Metales pesados, Método II<231>: no más de 20 ppm
Impurezas Orgánicas
• Procedimiento 1
Fase móvil y solución de idoneidad del sistema: Proceder según se indica en el Ensayo.
Solución estándar: 1,0 µg/mL de ER Tartrato de Rivastigmina USP en fase móvil
Solución muestra: 1,0 mg/mL de Tartrato de Rivastigmina en Fase móvil
Sistema cromatográfico: Proceder como se indica en el Ensayo.
(Consulte Cromatografía<621>, Idoneidad del sistema).
Idoneidad del sistema
Muestras: Solución de idoneidad del sistema y Solución estándar
Requisitos de idoneidad
Resolución: No menos de 1,5 entre el compuesto relacionado A de rivastigmina y el compuesto relacionado B de rivastigmina, Solución de idoneidad del sistema
Desviación estándar relativa: No más de 10%, Solución estándar
Análisis [Nota-El tiempo de ejecución es 8 veces el tiempo de retención del pico de rivastigmina. ]
Muestras: Solución estándar y Solución muestra
Calcule el porcentaje de cualquier impureza individual en la porción de tartrato de rivastigmina tomada:
Resultado = (rU/rS) × (CS/CU) × (1/F) × 100
rU = respuesta máxima para cada impureza de la Solución muestra
rS = respuesta máxima de la Solución estándar
CS = concentración de ER Tartrato de Rivastigmina USP en la Solución estándar (mg/mL)
CU = concentración de Tartrato de rivastigmina en la Solución muestra (mg/mL)
F = factor de respuesta relativa (ver Tabla de impurezas 1)
Criterios de aceptación
Impurezas individuales: consulte la Tabla de impurezas 1.
Impurezas totales: no más de 0,5%
Tabla de impurezas 1
| Nombre | Tiempo de retención relativo | Factor de respuesta relativa | Criterios de aceptación NMT % |
| tartrato | 0,18 | — | Ignorar |
| Impureza de fenol | 0,28 | 1.6 | 0.3 |
| DPTTAb | 0,46 | 0,83 | 0,15 |
| Ni impureza | 0,57 | 1.2 | 0,15 |
| Rivastigmina | 1.0 | 1.0 | — |
| Impureza de carbamato | 4.1 | 1.3 | 0,15 |
| impureza de éter | 6.5 | 1.4 | 0,15 |
| Cualquier otra impureza | — | 1.0 | 0.1 |
a (S)-3-[1-(Dimetilamino)etil]fenol.
b (+)-Di-(p-toluoil)-d-ácido tartárico (compuesto relacionado A de rivastigmina).
c (S)-3-[1-(Dimetilamino)etil]fenildimetilcarbamato (compuesto relacionado B de rivastigmina).
d 3-Etil(metil)carbamato de nitrofenilo.
e (S)-N,N-Dimetil-1-[3-(4-nitrofenoxi)fenil]etanamina.
• Procedimiento 2: Pureza Enantiomérica
Tampón: transferir 1,78 g de fosfato de sodio dibásico dihidrato y 1,38 g de fosfato de sodio monobásico a un matraz aforado de 1000 ml. Disolver y diluir con agua a volumen. Ajustar con ácido fosfórico a un pH de 6,0.
Fase móvil: Transferir 20 mL de acetonitrilo y 205 µL de N,N-dimetiloctilamina a un matraz volumétrico de 1000-mL y diluir a volumen con Tampón.
Solución estándar: 0,1 µg/mL de ER Tartrato de Rivastigmina R-ISómero USP en fase móvil
Solución de sensibilidad: 0,05 µg/mL de Tartrato de Rivastigmina R USP-RS Isómero en fase móvil, Solución estándar
Solución de idoneidad del sistema: 100 µg/mL de ER Tartrato de Rivastigmina USP y 0,1 µg/mL de ER Tartrato de Rivastigmina USP R-Isómero en fase móvil
Solución muestra: 100 µg/mL de Tartrato de Rivastigmina en Fase móvil
sistema cromatográfico
(Consulte Cromatografía<621>, Idoneidad del sistema).
Modo: LC
Detector: UV 200 nm
Columna: 4,0-mm × 10-cm; embalaje L41
Caudal: 0,5 ml/min
Tamaño de la inyección: 20 µL
Idoneidad del sistema
Muestras: Solución estándar, Solución de sensibilidad y Solución de idoneidad del sistema
Requisitos de idoneidad
Resolución: No menos de 0,8 entre los picos de enantiómero, Solución de idoneidad del sistema
[Nota-El orden de elución es el enantiómero R, seguido del pico de rivastigmina, que es el enantiómero S. ]
Relación señal-ruido: No menos de 10, solución de sensibilidad
Desviación estándar relativa: No más de 10%, Solución estándar
Análisis
Muestras: Solución estándar y Solución muestra
Calcule el porcentaje del enantiómero R en la porción de tartrato de rivastigmina tomada:
Resultado = (rU/rS) × (CS/CU) × 100
rU = respuesta máxima del enantiómero R-de la Solución muestra
rS = respuesta máxima del enantiómero R-de la Solución estándar
CS = concentración de R-enantiómero en la Solución estándar (μg/mL)
CU = concentración de Tartrato de rivastigmina en la Solución muestra (μg/mL)
Criterios de aceptación: No más de 0,3% del enantiómero R-
PRUEBAS ESPECÍFICAS
• Determinación de agua, Método Ia<921>: No más de 0,5%
REQUISITOS ADICIONALES
• Embalaje y almacenamiento: Consérvelo en recipientes herméticos y guárdelo a temperatura ambiente.
• Estándares de referencia USP<11>
ER Tartrato de Rivastigmina USP
ER Compuesto Relacionado A de Rivastigmina USP
Monohidrato de ácido di-p-toluoil-d-(+)-tartárico.
C20H20O9 404,37
ER Compuesto Relacionado B de Rivastigmina USP
N,N-ácido dimetilcarbámico-3-[1-éster (dimetilamino)etil]fenílico.
C13H20N2O2 236,32
ER Tartrato de Rivastigmina R-Isómero USP
¿Cómo comprar? Por favor contacteDr. Alvin Huang: sales@ruifuchem.com o alvin@ruifuchem.com
¿15 años de experiencia?Contamos con más de 15 años de experiencia en la fabricación y exportación de una amplia gama de productos químicos finos o intermedios farmacéuticos de alta calidad.
¿Principales mercados? Vender al mercado interno, América del Norte, Europa, India, Corea, Japón, Australia, etc.
¿Ventajas? Calidad superior, precio asequible, servicios profesionales y soporte técnico, entrega rápida.
Calidad Aseguramiento? Estricto sistema de control de calidad. Los equipos profesionales para análisis incluyen NMR, LC-MS, GC, HPLC, ICP-MS, UV, IR, OR, K.F, ROI, LOD, MP, claridad, solubilidad, prueba de límite microbiano, etc.
Muestras? La mayoría de los productos proporcionan muestras gratuitas para la evaluación de la calidad; el costo de envío debe ser pagado por los clientes.
Auditoría de fábrica? Bienvenida a la auditoría de fábrica. Por favor programe una cita con anticipación.
¿MOQ? Sin cantidad mínima de pedido. Se aceptan pedidos pequeños.
Tiempo de entrega? Si hay stock, entrega en tres días garantizada.
Transporte? Por expreso (FedEx, DHL), por aire, por mar.
¿Documentos? Servicio posventa: se pueden proporcionar COA, MOA, ROS, MSDS, etc.
Síntesis personalizada? Puede proporcionar servicios de síntesis personalizados que se adapten mejor a sus necesidades de investigación.
Condiciones de pago? La factura proforma se enviará primero después de la confirmación del pedido, adjuntando nuestros datos bancarios. Pago por T/T (Transferencia Télex), PayPal, Western Union, etc.
Documentos de identidad ONU ONU 2811 6.1 / PGII
WGK Alemania 3
RTECS FA9550000
Código SA 29242990
Clase de peligro 6.1
Grupo de embalaje III
El tartrato de rivastigmina (CAS: 129101-54-8) es el tartrato de rivastigmina, un fármaco para el tratamiento de la enfermedad de Alzheimer. La rivastigmina es un derivado de la fisostigmina desarrollado con éxito por primera vez por Novartis, Suiza. El nombre comercial es exelon y la molécula tiene una estructura de carbamato de bencilo, es un inhibidor selectivo de la colinesterasa (cerebro de carbamato), que puede inhibir la acetilcolinesterasa y la butirilcolinesterasa al mismo tiempo y promover la conducción nerviosa colinérgica al retrasar la degradación de la acetilcolina liberada por las neuronas colinérgicas. Puede mejorar la disfunción cognitiva mediada por colinérgicos, mejorando así el efecto cognitivo de los pacientes con enfermedad de Alzheimer. La capacidad de unión a proteínas plasmáticas de la rivastigmina es débil, atraviesa fácilmente la barrera hematoencefálica y tiene un alto grado de selectividad cerebral. No sólo puede actuar selectivamente en las áreas más vulnerables de la corteza cerebral y el hipocampo, sino que también inhibe preferentemente los subtipos dominantes de AChE en el cerebro, lo que puede reducir los efectos secundarios colinérgicos periféricos y al mismo tiempo producir efectos curativos. La vida media del tartrato de rivastigmina en el organismo es corta y el tiempo de acción es largo. A diferencia de la tacrina, este producto tiene un efecto inhibidor más fuerte sobre la enzima G1 en el hipocampo y la corteza. Se utiliza clínicamente para tratar la demencia de Alzheimer de leve a moderada, que se sospecha de enfermedad de Alzheimer o enfermedad de Alzheimer.
1. Como inhibidor de la acetilcolinesterasa, el bicartrato de rivastigmina puede mejorar el efecto del relajante muscular de la succinilcolina. Por lo tanto, debe haber un período intermitente adecuado para dejar de tomar este producto antes de la anestesia. Este producto debe combinarse con otras preparaciones colinérgicas o anticolinérgicas y se debe tener precaución (ver [Interacción con otros medicamentos]).
2. Debido a sus efectos farmacológicos, los inhibidores de la colinesterasa pueden tener efectos de tensión del nervio vago sobre la frecuencia cardíaca. Al igual que con otros fármacos colinérgicos, se debe tener precaución cuando se administra a pacientes con síndrome del seno enfermo u otro bloqueo cardíaco (ver Reacciones adversas).
3. La excitación del nervio colinérgico puede provocar un aumento de la secreción de ácido gástrico. Aunque no se encontró evidencia de un deterioro significativo de los síntomas correspondientes durante el período del ensayo clínico, los pacientes con un alto riesgo de úlcera gástrica, como aquellos con antecedentes de enfermedad ulcerosa o aquellos que reciben tratamiento concomitante con medicamentos antiinflamatorios no esteroideos, deben usarse con precaución.
4. Al igual que otros inhibidores de la colinesterasa, los pacientes con antecedentes de asma u otra enfermedad pulmonar obstructiva deben utilizarse con precaución.