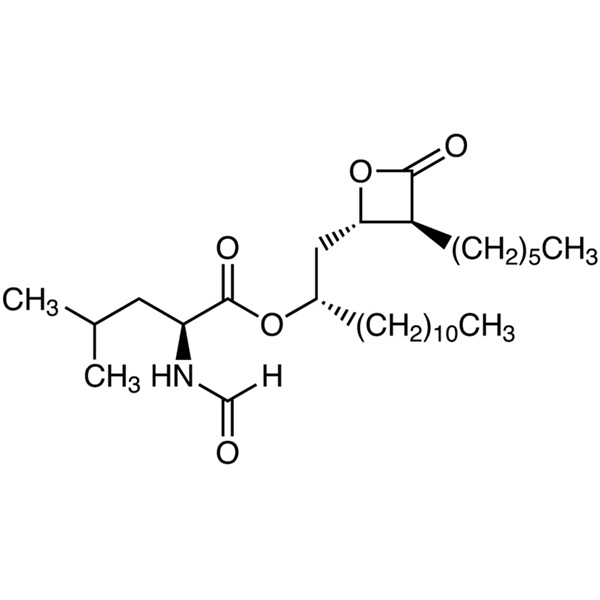
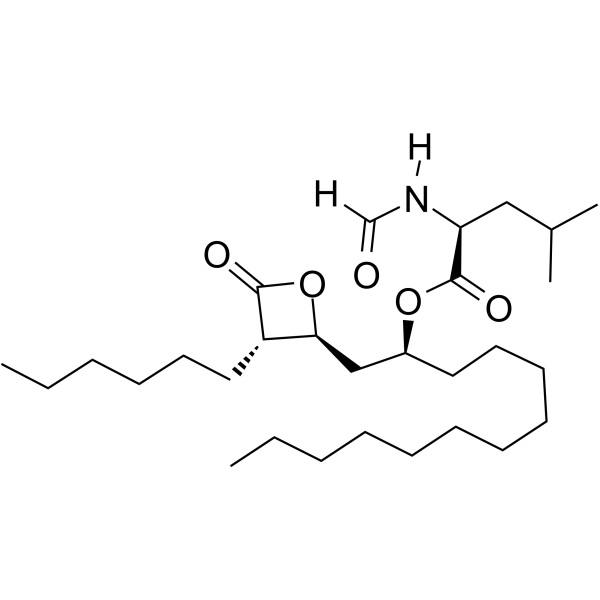
Orlistat CAS 96829-58-2 Pureza del fármaco para la pérdida de peso API 98,0~101,5%
Shanghai Ruifu Chemical Co., Ltd. es el fabricante líder de Orlistat (CAS: 96829-58-2) con un medicamento para bajar de peso de producción comercial y de alta calidad. Ruifu Chemical puede ofrecer entregas en todo el mundo, precios competitivos, excelente servicio y cantidades pequeñas y al por mayor disponibles. comprar orlistat, Por favor contacte: alvin@ruifuchem.com
| Nombre químico | Orlistato |
| Sinónimos | N-Formilo-L-Leucina (1S)-1-[[(2S,3S)-3-Hexil-4-Oxo-2-Oxetanil]Metil]Dodecil éster; (S)-2-Formilamino-4-Metil-Ácido pentanoico (S)-1-[[(2S,3S)-3-Hexil-4-Oxo-2-Oxetanil]Metil]-Dodecilo éster; tetrahidrolipstatina; Ro-18-0647 |
| Número CAS | 96829-58-2 |
| Estado del stock | En stock, la producción aumenta hasta toneladas |
| Fórmula molecular | C29H53NO5 |
| Peso Molecular | 495.75 |
| Punto de fusión | 43,0 ℃ ~ 48,0 ℃ |
| densidad | 0,976±0,06g/cm3 |
| sensible | Sensible al calor |
| Solubilidad | Soluble en cloroformo |
| Condición de envío | Bajo temperatura ambiente |
| COA y MSDS | Disponible |
| Marca | Química Ruifu |
| Artículo | Especificaciones |
| Apariencia | Polvo Cristalino Blanco o Casi Blanco |
| Identificación A | Absorción infrarroja |
| Identificación B | El tiempo de retención del pico principal de la Solución muestra corresponde al de la Solución estándar, tal como se obtiene en la Valoración. |
| Método de pureza/análisis | 98,0~101,5 % de C29H53NO5, calculado sobre una base anhidra y sin disolventes |
| Rotación específica | -48,0° ~ -51,0° |
| Determinación del agua | ≤0,20% |
| Residuo en el encendido | ≤0,10% |
| Metales pesados | ≤20 ppm |
| Compuesto relacionado A de orlistat | ≤0,20% |
| Compuesto relacionado B de orlistat | ≤0,05% |
| formileucinea | ≤0,20% |
| Compuesto relacionado C de orlistat | ≤0,05% |
| Epimer de anillo abierto de orlistat | ≤0,20% |
| D-Leucina Orlistat | ≤0,20% |
| Impureza individual no identificada | ≤0,10% |
| Compuesto relacionado D de orlistat | ≤0,20% |
| Amida de anillo abierto de orlistat | ≤0,10% |
| Compuesto relacionado E de orlistat | ≤0,20% |
| Impurezas totales | ≤1,00% |
| Estándar de prueba | Farmacopea China; USP35 |
| Uso | Ingrediente farmacéutico activo (API) |
Paquete: Botella, bolsa de papel de aluminio, tambor de cartón de 25 kg o según los requisitos del cliente.
Condición de almacenamiento: Mantenga el recipiente bien cerrado y guárdelo en un lugar fresco, seco (2 ~ 8 ℃) y bien ventilado, lejos de sustancias incompatibles. Manténgase alejado de la luz intensa, el calor y la humedad.
Envío: Entrega a todo el mundo por vía aérea, por FedEx / DHL Express. Proporcionar una entrega rápida y confiable.

Orlistat es una nueva forma de fármaco para bajar de peso reconocida internacionalmente. Su nombre comercial es Sainike y salió a la venta por primera vez en Nueva Zelanda en 1998. Orlistat es un inhibidor de la lipasa gastrointestinal específico a largo plazo y muy eficaz, y es insoluble en agua, soluble en cloroformo y fácilmente soluble en etanol. Orlistat se puede utilizar clínicamente para tratar la obesidad. Por lo general, se toma una dosis de 120 mg tres veces al día una hora después de una comida. La pérdida de peso comienza a ocurrir después de dos semanas de uso. Se puede utilizar de forma continua durante 6-12 meses y sus efectos dejarán de aumentar después de que la dosis diaria supere los 400 mg. Este medicamento es adecuado para ser utilizado en combinación con una dieta baja en calorías por parte de personas obesas y con sobrepeso, y también puede usarse como tratamiento a largo plazo para pacientes que han enfrentado factores de riesgo relacionados con el peso. Orlistat tiene un efecto de control de peso a largo plazo que reduce y mantiene el peso y previene los rebotes. El uso de Orlistat puede reducir la aparición de enfermedades y factores de riesgo relacionados con el peso, incluida la hipercolesterolemia, la diabetes tipo 2, la intolerancia a la glucosa, la hiperinsulinemia y la hipertensión, y puede reducir el contenido de grasa en los órganos. Orlistat también ajusta los niveles de lípidos en sangre: puede disminuir los triglicéridos séricos (TG) y el colesterol de lipoproteínas de baja densidad (LDL-C), y puede aumentar la proporción entre lipoproteínas de alta densidad y lipoproteínas de baja densidad en pacientes obesos.
Orlistato
C29H53NO5 495,73
l-Leucina, N-formilo-, éster 1-[(3-hexil-4-oxo-2-oxetanil)metil]dodecílico, [2S-[2(R*), 3]]-;
N-formil-l-leucina, éster con (3S,4S)-3-hexil-4-[(2S)-2-hidroxitridecil]-2-oxetanona [96829-58-2].
DEFINICIÓN
Orlistat contiene no menos de 98,0% y no más de 101,5% de C29H53NO5, calculado sobre una base anhidra y sin disolventes.
IDENTIFICACIÓN
• A. Absorción de infrarrojos<197M>
• B. El tiempo de retención del pico principal de la Solución muestra corresponde al de la Solución estándar, tal como se obtiene en la Valoración.
ENSAYO
• Procedimiento
[Nota-Evite el uso de matraces de plástico para la preparación o contención de cualquier solución en este análisis. ]
Fase móvil: Acetonitrilo, ácido fosfórico y agua (860:0,05:140)
Solución estándar: 0,5 mg/mL de USP Orlistat RS en fase móvil. Inyectar inmediatamente después de la preparación o almacenar a las 5.
Solución muestra: 0,5 mg/mL de Orlistat en Fase móvil. Inyectar inmediatamente después de la preparación o almacenar a las 5.
sistema cromatográfico
(Consulte Cromatografía<621>, Idoneidad del sistema).
Modo: LC
Detector: UV 195
Columna: 3,9-mm × 15-cm; 4-μm empaquetadura L1
Caudal: 1,0 ml/min
Tamaño de la inyección: 20 µL
Idoneidad del sistema
Muestra: Solución estándar
Requisitos de idoneidad
Desviación estándar relativa: no más de 2,0%
Análisis
Muestras: Solución estándar y Solución muestra
Calcule el porcentaje de orlistat (C29H53NO5) en la porción de Orlistat tomada:
Resultado = (rU/rS) × (CS/CU) × 100
rU = respuesta máxima de la Solución muestra
rS = respuesta máxima de la Solución estándar
CS = concentración de ER Orlistat USP en la Solución estándar (mg/mL)
CU = concentración de Orlistat en la Solución muestra (mg/mL)
Criterios de aceptación: 98,0%-101,5% en forma anhidra, libre de solventes
IMPUREZAS
Impurezas inorgánicas
• Residuo en la ignición<281>: No más de 0,1%
• Metales pesados, Método II<231>: 20 ppm
Impurezas Orgánicas
• Procedimiento 1: Límite del compuesto relacionado A de orlistat
Solución estándar: 0,1 mg/mL de ER Compuesto Relacionado A de Orlistat USP en acetona
Solución muestra: 50 mg/mL de Orlistat en acetona
sistema cromatográfico
(Ver Cromatografía<621>, Cromatografía en capa fina).
Modo: cariño
Adsorbente: capa de 0,25 -mm de mezcla de gel de sílice cromatográfica
Volumen de aplicación: 10 µL
Sistema de disolvente de revelado: tolueno y acetato de etilo (4:1)
Solución de detección: transferir 2,5 g de ácido fosfomolíbdico y 1 g de sulfato cérrico a un matraz volumétrico de 100 ml, disolver y diluir con metanol a volumen.
Análisis
Muestras: Solución estándar y Solución muestra
Retire la placa y séquela bien al aire. Rocíe la placa seca con solución de detección y coloque la placa en un horno a 120ºC durante 30 min.
Criterio de aceptación: Cualquier mancha secundaria de la Solución muestra correspondiente al compuesto relacionado A de orlistat no es más intensa que la mancha correspondiente de la Solución estándar (0,2%).
• Procedimiento 2: Límite del compuesto relacionado B de orlistat
Solución estándar: 0,025 mg/mL de ER Compuesto Relacionado B de Orlistat USP en cloruro de metileno
Solución muestra: 50 mg/mL de Orlistat en cloruro de metileno
Solución de muestra enriquecida: 50 mg/mL de Orlistat en Solución estándar
sistema cromatográfico
(Consulte Cromatografía<621>, Idoneidad del sistema).
Modo: GC
Detector: Ionización de llama
Columna: sílice fundida de 0,32-mm x 30-m, recubierta con una fase estacionaria G27 de 0,25-μm
Temperatura de la columna: consulte la tabla de programas de temperatura a continuación.
Temperatura inicial () Rampa de temperatura (/min) Temperatura final () Tiempo de mantenimiento a temperatura final (min)
50 4 170 -
170 30 300 30
Temperatura
Inyector: 270
detectores: 280
Gas portador: helio
Caudal: 30 ml/min
Relación de división: 10:1
Tamaño de la inyección: 2 µL
Idoneidad del sistema
Muestra: Solución estándar
Requisitos de idoneidad
Desviación estándar relativa: no más de 10,0%
Análisis
Muestras: Solución de muestra y Solución de muestra enriquecida
Calcule el porcentaje del compuesto relacionado B de orlistat en la porción de Orlistat tomada:
Resultado = [rU/(rSP rU)] × (CS/CT) × 100
rU = respuesta máxima del compuesto relacionado B de orlistat de la Solución muestra
rSP = respuesta máxima del compuesto B relacionado con orlistat de la solución de muestra enriquecida
CS = concentración de ER Compuesto Relacionado B de Orlistat USP en la Solución estándar (mg/mL)
CT = concentración de Orlistat en la solución de muestra enriquecida (mg/ml)
Criterios de aceptación: No más de 0,05% de compuesto relacionado B de orlistat.
• Procedimiento 3
[Nota-Evite el uso de matraces de plástico para la preparación o contención de cualquier solución en este análisis. ]
Fase móvil, Solución estándar y Solución muestra: Preparar según se indica en la Valoración.
Solución de idoneidad del sistema: 10 µg/mL de ER Orlistat USP, 0,1 µg/mL de ER Compuesto Relacionado C de Orlistat USP y 0,25 µg/mL de ER Compuesto Relacionado D de Orlistat USP en fase móvil
sistema cromatográfico
(Consulte Cromatografía<621>, Idoneidad del sistema).
Proceda como se indica en el Ensayo, excepto para cromatografíar la solución de idoneidad del sistema.
Idoneidad del sistema
Ejemplo: solución de idoneidad del sistema
Requisitos de idoneidad
Relación señal-ruido: No menos de 3 para los picos del compuesto relacionado C con orlistat y del compuesto relacionado D con orlistat
Desviación estándar relativa: no más de 10,0 % para el pico de orlistat
Análisis
Muestras: Solución estándar y Solución muestra
Calcule el porcentaje de cada impureza en la porción de Orlistat tomada:
Resultado = (rU/rS) × (CS/CU) × (1/F) × 100
rU = respuesta máxima para cada impureza individual de la Solución muestra
rS = respuesta máxima de Orlistat RS USP de la Solución estándar
CS = concentración de ER Orlistat USP en la Solución estándar (mg/mL)
CU = concentración de Orlistat en la Solución muestra (mg/mL)
F = factor de respuesta relativa como se indica en la Tabla de impurezas 1
Criterios de aceptación: Ver Tabla de Impurezas 1.
Tabla de impurezas 1
Nombre Tiempo de retención relativo Factor de respuesta relativo Criterios de aceptación, no más (%)
Formileucinea 0,10 4,0 0,2
Compuesto relacionado de orlistat C 0,13 33 0,05
Orlistat epimerb de anillo abierto 0,44 1,0 0,2
Compuesto relacionado de orlistat D* 0,90 - Calculado en
Procedimiento 4
Orlistat de anillo abierto amidec* 0,90 - Calculado en
Procedimiento 4
Orlistat 1,00 - -
d-Leucina orlistatd 1,18 1,0 0,2
Impureza individual no identificada - 1,0 0,1
* Coelutos en este sistema LC, determinados mediante el Procedimiento 4.
una N-formil-l-leucina.
b (2S,3R,5S)-5-[(S)-2-formilamino-4-metil-pentanoiloxi]-2-hexil-3-hidroxi-ácido hexadecanoico.
c N-formil-l-leucina (S)-1-[(2S,3S)-2-hidroxi-3-[1-fenil-R-etilcarbomoil]nonil]-éster dodecílico.
d N-Formil-d-leucina (S)-1-[[(2S,3S)-3-hexil-4-oxo-2-oxetanil]metil]dodecílico éster o enantiómero.
• Procedimiento 4: Límite del compuesto relacionado D de orlistat
Fase móvil: Metanol y agua (83:17)
Solución de idoneidad del sistema: 4 mg/mL de ER Orlistat USP y 2,4 µg/mL de ER Compuesto Relacionado D Orlistat USP en acetonitrilo, respectivamente
Solución estándar: 5,0 mg/mL de ER Orlistat USP en acetonitrilo
Solución muestra: 5,0 mg/mL de Orlistat en acetonitrilo
sistema cromatográfico
(Ver Cromatografía 621, Idoneidad del sistema).
Modo: LC
Detector: 205 nm
Columna: 4,0-mm × 25-cm; 5-μm empaquetadura L7
Caudal: 0,6 ml/min
Tamaño de la inyección: 20 µL
Idoneidad del sistema
Ejemplo: solución de idoneidad del sistema
Requisitos de idoneidad
Relación señal-ruido: No menos de 3 para el pico del compuesto relacionado con orlistat D
Desviación estándar relativa: no más de 10,0 % para el pico de orlistat
Análisis
Muestras: Solución estándar y Solución muestra
Calcule el porcentaje de cada impureza en la porción de Orlistat tomada:
Resultado = (rU/rS) × (CS/CU) × (1/F) × 100
rU = respuesta máxima para cada impureza individual de la Solución muestra
rS = respuesta máxima para Orlistat RS USP de la Solución estándar
CS = concentración de ER Orlistat USP en la Solución estándar (μg/mL)
CU = concentración de Orlistat en la Solución muestra (μg/mL)
F = factor de respuesta relativa obtenido en la Tabla de impurezas 2
Criterios de aceptación: Ver Tabla de Impurezas 2.
Tabla de impurezas 2
Nombre Tiempo de retención relativo Factor de respuesta relativo Criterios de aceptación, no más (%)
Compuesto relacionado con orlistat D 0,94 1,0 0,2
Orlistat 1,00 - -
Orlistat de anillo abierto amidaa 1,25 4,3 0,1
un éster dodecílico de N-formil-l-leucina (S)-1-[(2S,3S)-2-hidroxi-3-[1-fenil-R-etilcarbomoil]nonil]-.
• Procedimiento 5: Límite del compuesto relacionado E de orlistat
Tampón: solución de borato 0,4 N, ajustada a un pH de 10,2
Agente derivatizante: o-Solución de ftaldehído (OPA). [Nota - Si no se puede obtener comercialmente, el agente derivatizante se puede preparar como 1% de ácido 3-mercaptopropiónico y oftaldialdehído en una solución tampón de borato 0,4 M.]
Solución A: Transfiera 4,1 g de acetato de sodio trihidrato y 40 mg de ácido etilendiaminotetraacético (EDTA) a un matraz aforado de 1 -L. Disolver en 950 ml de agua y ajustar con hidróxido de sodio 0,1 N a un pH de 7,2. Diluir a volumen con agua, añadir 2,5 ml de tetrahidrofurano y mezclar. Filtrar y desgasificar.
Solución B: Transfiera 2,7 g de acetato de sodio trihidrato y 40 mg de EDTA a un matraz aforado de 1 l. Disolver en 200 ml de agua y ajustar con hidróxido de sodio 0,1 N a un pH de 7,2. Añadir 800 ml de acetonitrilo, filtrar y desgasificar.
Fase móvil: consulte la tabla de gradientes a continuación.
Tiempo (min) Solución A (%) Solución B (%)
0 96,7 3,3
20 60 40
24 0 100
38 0 100
38 96,7 3,3
45 96,7 3,3
Solución estándar: Transfiera una cantidad pesada de aproximadamente 0,2 mg de ER Compuesto relacionado E de Orlistat USP a un vial con espacio de cabeza de 20 ml. Agregue 10 ml de hidróxido de sodio 4 N y cierre el vial. Calentar el vial a 100ºC durante 1 h, luego dejar enfriar a temperatura ambiente. Transferir 2 ml de la solución resultante a un matraz volumétrico de 50 ml y diluir a volumen con agua. A 0,5 ml de esta solución agregue 2,0 ml de tampón y 0,5 ml de agente derivatizante.
Solución de muestra: Proceder según las indicaciones para la Solución estándar, pero en su lugar usar 25 mg de Orlistat para reemplazar los 0,2 mg de ER Compuesto Relacionado E de Orlistat USP.
sistema cromatográfico
(Consulte Cromatografía<621>, Idoneidad del sistema).
Modo: LC
Detector: Fluorescencia 340 nm (excitación); 450 nm (emisión)
columnas
Protector: 2,1-mm × 2-cm; 50-μm empaquetadura L1
Analítico: 2,1-mm × 20-cm; embalaje L1
Caudal: 0,5 ml/min
Tamaño de la inyección: 20 µL
Idoneidad del sistema
Muestra: Solución estándar
Requisitos de idoneidad
Desviación estándar relativa: No más de 6,0 % para el pico E del compuesto relacionado con orlistat
Análisis
Muestras: Solución estándar y Solución muestra
Calcule el porcentaje de esta impureza en la porción de Orlistat tomada:
Resultado = (rU/rS) × (CS/CU) × 100
rU = respuesta máxima para el compuesto relacionado E de orlistat en la Solución muestra
rS = respuesta máxima del ER Compuesto Relacionado E de Orlistat USP en la Solución estándar
CS = concentración de ER Compuesto Relacionado E de Orlistat USP en la Solución estándar (mg/mL)
CU = concentración de Orlistat en la Solución muestra (mg/mL)
Criterios de aceptación
Impureza individual: No más de 0,2% del compuesto relacionado E de orlistat.
Impurezas totales: Se encuentra no más de 1,0% del total de impurezas, sumándose los resultados de los Procedimientos 1, 2, 3, 4 y 5.
PRUEBAS ESPECÍFICAS
• Rotación óptica, rotación específica<781>
Solución muestra: 30 mg/mL en alcohol deshidratado
Criterios de aceptación: Entre -48,0 y -51,0, a 20
• Determinación de agua, Método Ic<921>: No más de 0,2%
REQUISITOS ADICIONALES
• Envasado y Almacenamiento: Conservar en recipientes bien cerrados entre 2 y 8℃.
• Estándares de referencia USP<11>
USP Orlistat RS
ER Compuesto Relacionado A Orlistat USP
ER Compuesto Relacionado B de Orlistat USP
ER Compuesto Relacionado C de Orlistat USP
ER Compuesto Relacionado D de Orlistat USP
ER Compuesto Relacionado E de Orlistat USP
USP35