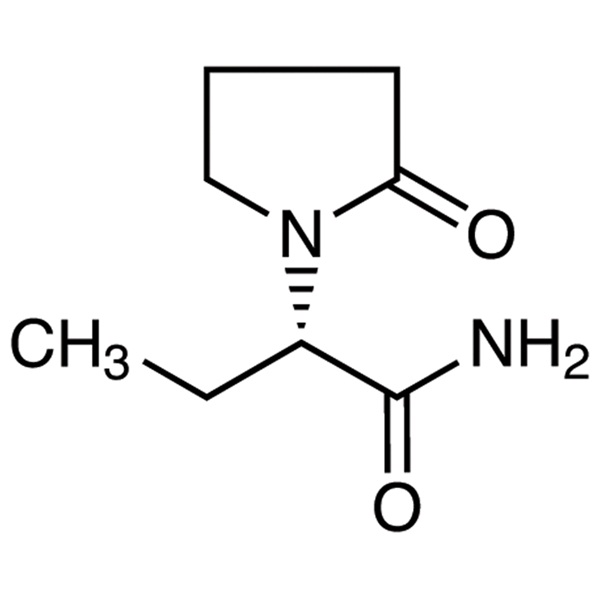
Levetiracetam LEV CAS 102767-28-2 Ensayo 98,0%~102,0% Estándar USP EP
Shanghai Ruifu Chemical Co., Ltd. es el fabricante líder de levetiracetam (CAS: 102767-28-2) con alta calidad y calidad estable, API, estándar USP/EP, fármaco antiepiléptico de tercera generación. Ruifu Chemical puede ofrecer entregas en todo el mundo, precios competitivos, excelente servicio y cantidades pequeñas y al por mayor disponibles. comprar levetiracetam, Por favor contacte: alvin@ruifuchem.com
| Nombre químico | levetiracetam |
| Sinónimos | LEV; (S)-2-(2-Oxo-1-pirrolidinil)butiramida; UCB-L059; (S)-alfa-Etil-2-Oxo-1-Pirrolidinaacetamida; (2S)-2-(2-Oxopirrolidina-1-il)butanamida |
| Número CAS | 102767-28-2 |
| Estado del stock | En stock, capacidad de producción 500 toneladas por año. |
| Fórmula molecular | C8H14N2O2 |
| Peso Molecular | 170.21 |
| Punto de fusión | 116,0 ~ 119,0 ℃ |
| densidad | 1,168g/cm3 |
| Solubilidad | Soluble en acetona |
| COA y MSDS | Disponible |
| Origen del producto | Shanghái, China |
| Categorías de productos | Antiepiléptico; API (ingrediente farmacéutico activo) |
| Marca | Química Ruifu |
| Artículo | Especificaciones |
| Apariencia | Polvo de cristales blancos o casi blancos |
| Identificación | IR |
| Aparición de la solución | Claro y no más intensamente coloreado que BY6 |
| Límite de levetiracetam R-Enantiómero | ≤0,80% |
| Agua (por K.F) | ≤0,50% |
| Residuo en el encendido | ≤0,10% |
| Metales pesados | ≤0,001% |
| Sustancias relacionadas | |
| Piridina-2-ol | ≤0,025% |
| Ácido levetiracetam | ≤0,30% |
| Compuesto relacionado A de levetiracetam | ≤0,05% |
| Compuesto relacionado B de levetiracetam | ≤0,10% |
| Cualquier impureza individual no especificada | ≤0,05% |
| Total de impurezas no especificadas | ≤0,10% |
| Impurezas totales | ≤0,40% |
| Solventes residuales | Cumplir con las especificaciones |
| Método de ensayo/análisis | 98,0%~102,0% (calculado en base anhidra y sin disolventes) |
| Estándar de prueba | Estándar USP; Estándar EP |
| Solicitud | API; Medicamento antiepiléptico de tercera generación |
Paquete: Botella, Bolsa de papel de aluminio, 25kg/Bidón de Cartón, o según requerimiento del cliente.
Condición de almacenamiento: Mantener el recipiente bien cerrado y almacenar en un almacén fresco, seco y bien ventilado, lejos de sustancias incompatibles. Mantener alejado de la luz del sol; evitar el fuego y las fuentes de calor; evitar la humedad.
Envío: Entrega a todo el mundo por vía aérea, mediante FedEx / DHL Express. Proporcionar una entrega rápida y confiable.
levetiracetam
C8H14N2O2 170,21
1-pirrolidinaacetamida, -etil-2-oxo-, (S)-;
()-(S)--Etil-2-oxo-1-pirrolidinaacetamida [102767-28-2].
DEFINICIÓN
El levetiracetam contiene no menos de 98,0% y no más de 102,0% de C8H14N2O2, calculado sobre una base anhidra y libre de solventes.
IDENTIFICACIÓN
• A. Absorción de infrarrojos<197K>
• B. El tiempo de retención del pico principal de levetiracetam de la Solución muestra corresponde al del enantiómero S-de levetiracetam de la Solución de idoneidad del sistema, según se obtuvo en la prueba de Límite del Enantiómero R-de levetiracetam.
ENSAYO
• Procedimiento
Tampón: 2,7 g/L de fosfato monobásico de potasio en agua. Ajustar con hidróxido de potasio acuoso al 2% (p/v) a un pH de 5,5.
Solución A: Acetonitrilo y tampón (1:19)
Solución B: Acetonitrilo
Fase móvil: consulte la tabla de gradientes a continuación.
Tiempo (min) Solución A (%) Solución B (%)
0 100 0
3 100 0
20 71 29
Solución de idoneidad del sistema: 0,2 mg/mL de ER Levetiracetam USP y 0,08 mg/mL de ER Compuesto Relacionado A de Levetiracetam USP en Solución A. Prepárese disolviendo primero la cantidad requerida de ER Levetiracetam USP en un matraz volumétrico adecuado. Añadir el 10% del volumen del matraz de hidróxido de potasio 0,1 N. Dejar reaccionar la mezcla a temperatura ambiente durante aproximadamente 15 min y luego neutralizar añadiendo ácido clorhídrico 0,1 N al 10% del volumen del matraz. Agregar la cantidad requerida de ER Compuesto Relacionado A de Levetiracetam USP, sonicar para disolver, diluir a volumen con Solución A y mezclar.
Solución estándar: 0,1 mg/mL de ER Levetiracetam USP en Solución A
Solución muestra: 0,1 mg/mL de Levetiracetam en Solución A
sistema cromatográfico
(Consulte Cromatografía<621>, Idoneidad del sistema).
Modo: LC
Detector: UV 205 nm
Columna: 4,6-mm × 15-cm; embalaje L1
Caudal: 0,9 ml/min
Tamaño de la inyección: 10 µL
Idoneidad del sistema
Ejemplo: solución de idoneidad del sistema
[Nota-Los tiempos de retención relativos se dan en la Tabla de impurezas 1.]
Requisitos de idoneidad
Desviación estándar relativa: no más de 1,0%
[Nota - Si no se pueden cumplir los criterios de idoneidad del sistema, se recomienda mantener la temperatura de la columna en 20ºC para estabilizar el sistema.]
Análisis
Muestras: Solución estándar y Solución muestra
Calcule el porcentaje de C8H14N2O2 en la porción de levetiracetam tomada:
Resultado = [(rU/rS) × (CS/CU) × 100] F
rU = respuesta máxima de levetiracetam de la Solución muestra
rS = respuesta máxima de levetiracetam de la Solución estándar
CS = concentración de ER Levetiracetam USP en la Solución estándar (mg/mL)
CU = concentración de levetiracetam en la solución muestra (mg/mL)
F = porcentaje de levetiracetam R-enantiómero de la prueba de límite de levetiracetam R-Enantiómero
Criterios de aceptación: 98,0%-102,0% en forma anhidra y sin disolventes
IMPUREZAS
Impurezas inorgánicas
• Residuo en la ignición<281>: No más de 0,1%
• Metales pesados, Método II<231>: 20 ppm
Impurezas Orgánicas
• Procedimiento 1: Límite del compuesto relacionado B de levetiracetam
[Nota-Realice esta prueba sólo si el compuesto relacionado B de levetiracetam es una impureza del proceso conocida.]
Tampón: 1,22 g de 1-decanosulfonato de sodio en 1 litro de agua que contiene aproximadamente 1,3 ml de ácido fosfórico. Ajustar con hidróxido de potasio al 20% (p/v) a un pH de 3,0.
Fase móvil: Acetonitrilo y Tampón (3:17)
Solución de idoneidad del sistema: 2 mg/mL de ER Compuesto Relacionado B de Levetiracetam USP en fase móvil
Solución estándar: 0,002 mg/mL de ER Compuesto Relacionado B de Levetiracetam USP en fase móvil
Solución muestra: 2,0 mg/mL de Levetiracetam en Fase móvil
sistema cromatográfico
(Ver Cromatografía 621, Idoneidad del sistema).
Modo: LC
Detector: UV 200 nm
Columna: 4,6-mm × 25-cm; embalaje L1
Caudal: 1,0 ml/min
Tamaño de inyección
Idoneidad del sistema: 10 µL
Análisis: 50 µL
Idoneidad del sistema
Ejemplo: solución de idoneidad del sistema
[Nota - El tiempo de retención del compuesto relacionado B de levetiracetam es de 9 min.]
Requisitos de idoneidad
Factor de cola: No más de 3,0
[Nota - Si se observa una cola significativa del pico del compuesto relacionado B de levetiracetam (superior a 3,0), se recomienda mantener la temperatura de la columna a 27ºC para estabilizar el sistema.]
Desviación estándar relativa: no más de 2,0%
Análisis
Muestras: Solución estándar y Solución muestra
Calcule el porcentaje del compuesto relacionado B de levetiracetam en la porción de levetiracetam tomada:
Resultado = (rU/rS) × (CS/CU) × (Mr1/Mr2) × 100
rU = respuesta máxima del compuesto relacionado B de levetiracetam de la Solución muestra
rS = respuesta máxima del compuesto relacionado B de levetiracetam de la Solución estándar
CS = concentración de ER Compuesto Relacionado B de Levetiracetam USP en la Solución estándar (mg/mL)
CU = concentración de levetiracetam en la solución muestra (mg/mL)
Mr1 = peso molecular de la base libre del compuesto relacionado B de levetiracetam, 102,1
Mr2 = peso molecular del compuesto relacionado B de levetiracetam, 138,6
Criterios de aceptación: No más de 0,10%
[Nota-La cantidad medida de compuesto relacionado B de levetiracetam debe incluirse en las impurezas totales en la prueba de impurezas orgánicas, Procedimiento 2.]
• Procedimiento 2
Tampón, Solución A, Solución B, Fase móvil, Solución de idoneidad del sistema y Sistema cromatográfico: Proceder según se indica en el Ensayo.
Solución estándar: 0,005 mg/mL de ER Levetiracetam USP en Solución A
Solución muestra: 5 mg/mL de Levetiracetam en Solución A
Análisis
Muestras: Solución estándar y Solución muestra
Calcule el porcentaje de cada impureza en la porción de levetiracetam tomada:
Resultado = (rU/rS) × (CS/CU) × (1/F) × 100
rU = respuesta máxima de cada impureza de la Solución muestra
rS = respuesta máxima de levetiracetam de la Solución estándar
CS = concentración de ER Levetiracetam USP en la Solución estándar (mg/mL)
CU = concentración de levetiracetam en la solución muestra (mg/mL)
F = factor de respuesta relativa (ver Tabla de impurezas 1)
[Nota-Ignore cualquier pico con un tiempo de retención relativo de 0,19 o menos.]
Criterios de aceptación
Impurezas individuales: consulte la Tabla de impurezas 1.
Impurezas totales: no más de 0,4%
Tabla de impurezas 1
Nombre Tiempo de retención relativo Factor de respuesta relativo Criterios de aceptación, no más (%)
Piridina-2-ol a 0,37 1,0 0,025
Ácido levetiracetamb 0,62 1,2 0,3
Levetiracetam 1,00 - -
Compuesto relacionado del levetiracetam Ac 1,25 0,35 0,05
Cualquier impureza individual no especificada - 1,0 0,05
a No incluido en el límite total de impurezas.
b Ácido (S)-2-(2-Oxopirrolidin-1-il)butanoico. Incluido en el límite total de impurezas.
c (S)-N-(1-Amino-1-oxobutan-2-il)-4-clorobutanamida. Incluido en el límite total de impurezas solo si el compuesto relacionado B de levetiracetam es una impureza de proceso conocida.
PRUEBAS ESPECÍFICAS
• Determinación de agua, Método Ia<921>: No más de 0,5%
• Límite de levetiracetam R-Enantiómero
Fase móvil: n-Hexano y alcohol deshidratado (4:1)
Solución de idoneidad del sistema: 0,1 mg/mL de ER Mezcla Racémica de Levetiracetam USP en fase móvil
Solución estándar: 0,05 mg/mL de ER Levetiracetam USP en fase móvil
Solución muestra: 10 mg/mL de Levetiracetam en Fase móvil
sistema cromatográfico
(Consulte Cromatografía<621>, Idoneidad del sistema).
Modo: LC
Detector: UV 215 nm
Columna: 4,6-mm × 25-cm; 10-μm empaquetadura L51
Caudal: 1,0 ml/min
Tamaño de la inyección: 20 µL
Idoneidad del sistema
Ejemplo: solución de idoneidad del sistema
[Nota-Los tiempos de retención relativos para el enantiómero R de levetiracetam y el enantiómero S de levetiracetam son 0,55 y 1,0, respectivamente.]
Requisitos de idoneidad
Resolución: No menos de 4.0 entre R- y S-enantiómeros
[Nota - Si se observa una pérdida de resolución (menos de 4,0), se recomienda mantener la temperatura de la columna en 25ºC para estabilizar el sistema.]
Análisis
Muestras: Solución estándar y Solución muestra
Calcule el porcentaje de levetiracetam R-enantiómero en la porción de levetiracetam tomada:
Resultado = (rU/rS) × (CS/CU) × 100
rU = respuesta máxima del enantiómero R de levetiracetam de la Solución muestra
rS = respuesta máxima de levetiracetam de la Solución estándar
CS = concentración de ER Levetiracetam USP en la Solución estándar (mg/mL)
CU = concentración de levetiracetam en la solución muestra (mg/mL)
Criterios de aceptación: No más de 0,8%
REQUISITOS ADICIONALES
• Envasado y almacenamiento: Conservar en recipientes bien cerrados y almacenar a temperatura ambiente.
• Estándares de referencia USP<11>
Levetiracetam ER USP
ER Mezcla Racémica de Levetiracetam USP
Una mezcla 1:1 de levetiracetam S-enantiómero-(2S)-2-(2-oxopirrolidin-1-il)butanamida y levetiracetam R-enantiómero (2R)-2-(2-oxopirrolidin-1-il)butanamida.
ER Compuesto Relacionado A de Levetiracetam USP
(S)-N-(1-Amino-1-oxobutan-2-yl)-4-clorobutanamida.
C8H14ClNO3 207,65
ER Compuesto Relacionado B de Levetiracetam USP
(S)-2-Clorhidrato de aminobutanamida.
C4H10N2O·HCl 138,6

El levetiracetam (CAS: 102767-28-2), un derivado del pilacetam, es un nuevo fármaco antiepiléptico de tercera generación aprobado por la FDA de EE. UU. en 1999. Inicialmente se utilizó para el tratamiento complementario de las convulsiones parciales en adultos. En 2005, se aprobó el levetiracetam en tabletas y soluciones orales para el tratamiento complementario de las convulsiones parciales en niños de 4 años en adelante. Se utiliza principalmente para el tratamiento aditivo de convulsiones parciales en adultos y niños mayores de 4 años, y también puede utilizarse sólo para convulsiones parciales y convulsiones sistémicas en adultos. También tiene cierto efecto curativo sobre la epilepsia mioclónica en adolescentes, la epilepsia refractaria, la epilepsia ausente en niños y la epilepsia persistente.