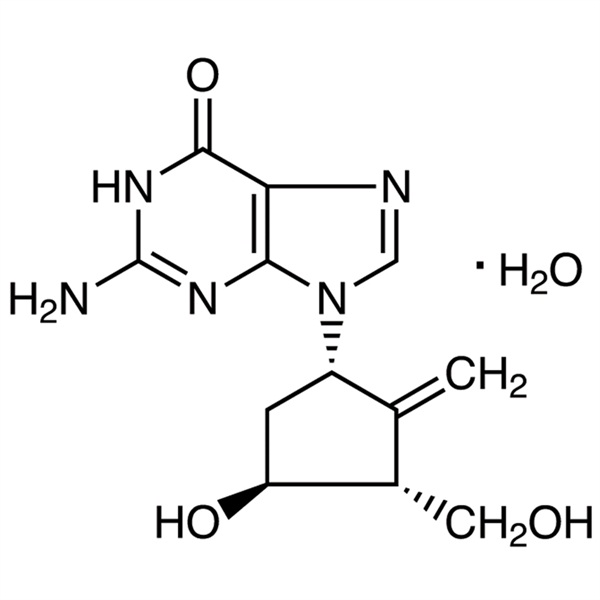
Monohidrato de entecavir CAS 209216-23-9 Ensayo 98,0%~102,0% API USP EP Infección antiviral estándar contra la hepatitis B
Ruifu Chemical es el proveedor líder de monohidrato de entecavir (CAS: 209216-23-9) de alta calidad, puede cumplir con el estándar USP/EP, utilizado en el tratamiento de la infección por hepatitis B.
Ruifu lleva más de 15 años suministrando API e intermedios farmacéuticos.
Ruifu Chemical puede ofrecer entregas en todo el mundo, precios competitivos y excelente servicio.
Comprar monohidrato de entecavir, por favor contáctenos por correo electrónico: alvin@ruifuchem.com
| Nombre químico | Monohidrato de entecavir |
| Sinónimos | Hidrato de entecavir; 9-[(1S,3R,4S)-4-Hidroxi-3-(hidroximetil)-2-metilenciclopentil]guanina monohidrato |
| Número CAS | 209216-23-9 |
| Estado del stock | En stock, la producción aumenta hasta toneladas |
| Fórmula molecular | C12H17N5O4 |
| Peso Molecular | 295,3 |
| Punto de fusión | >220℃ |
| densidad | 1.81 |
| Condición de envío | Enviado bajo temperatura ambiente |
| COA y MSDS | Disponible |
| Origen del producto | Shanghái, China |
| Categorías de productos | API (ingrediente farmacéutico activo) |
| Marca | Química Ruifu |
| Artículo | Especificaciones |
| Apariencia | Polvo cristalino blanco o casi blanco |
| Solubilidad | Totalmente soluble en dimetilformamida, ligeramente soluble en agua, etanol y metanol |
| Identificación IR | El espectro de la muestra corresponde al del estándar de referencia. |
| Identificación HPLC | El tiempo de retención de la muestra de prueba corresponde al del estándar de referencia. |
| Contenido de agua (por K.F) | 5,5%~6,5% |
| Rotación óptica específica | +24,0° a +30,0° (DMF: MeOH=1:1 C=1%) (sobre sustancia anhidra) |
| Residuo en el encendido | ≤0,10% |
| Sustancias relacionadas | |
| furoentecavir | ≤0,10% |
| Entecavir 1-Epímero | ≤0,10% |
| Entecavir 3-Epímero | ≤0,10% |
| 8-Hidroxi-Entecavir | ≤0,10% |
| Entecavir 4-Epímero | ≤0,10% |
| 8-Metoxi entecavir | ≤0,10% |
| 4-Dimetilsilil entecavir | ≤0,10% |
| Compuesto relacionado A de entecavir | ≤0,10% |
| Cualquier impureza no especificada | ≤0,10% |
| Impurezas totales | ≤0,30% |
| Solventes residuales | |
| Metanol | ≤600 ppm |
| diclorometano | ≤300 ppm |
| Acetato de etilo | ≤1000 ppm |
| tetrahidrofurano | ≤720 ppm |
| tolueno | ≤890 ppm |
| Cloruro de bencilo | ≤1000 ppm |
| Alcohol bencílico | ≤1000 ppm |
| Límite microbiano | |
| Recuentos aeróbicos totales | ≤100ufc/g |
| Levaduras y mohos | ≤10ufc/g |
| Escherichia Coli | No debería detectarse |
| Metales pesados | ≤10 ppm |
| Ensayo | 98,0%~102,0% (HPLC; en base anhidra) |
| Tamaño de partícula | El 95 % de las partículas deben estar dentro de los 125 μm. |
| Estándar de prueba | Estándar empresarial; Estándar de la Farmacopea de los Estados Unidos (USP) |
| Uso | Medicamento antiviral utilizado en el tratamiento de la infección por hepatitis B. |
Paquete: Botella, bolsa de papel de aluminio, 25 kg/tambor de cartón, o según requerimiento del cliente.
Condición de almacenamiento: Mantener el recipiente bien cerrado. Almacenar en un lugar fresco, seco (2-15 ℃) y bien ventilado, lejos de sustancias incompatibles. Mantener alejado de la luz del sol; evitar el fuego y las fuentes de calor; evitar la humedad.
Envío: Entrega a todo el mundo por aire, mar, por FedEx / DHL Express. Proporcionar una entrega rápida y confiable.

| Descripción de seguridad | 24/25 - Evite el contacto con la piel y los ojos. |
| Código HS | 2933990099 |
El monohidrato de entecavir (CAS 209216-23-9) es un fármaco antiviral oral que se utiliza en el tratamiento de la infección por el virus de la hepatitis B (VHB). El monohidrato de entecavir es un análogo de nucleósido (más específicamente, un análogo de guanina) que inhibe la transcripción inversa, la replicación del ADN y la transcripción en el virus. Es un nuevo tipo de medicamento contra el virus de la hepatitis B ciclopentil acil guanosina con efectos farmacológicos similares a los del entecavir. Se aplica clínicamente al tratamiento de la hepatitis B crónica en adultos en la que hay replicación viral activa, aumento de las transaminasas séricas ALT o lesiones activas mostradas en la histología hepática. El monohidrato de entecavir es un inhibidor potente y selectivo del VHB, con una CE50 de 3,75 nM en las células HepG2. Entecavir es un inhibidor de la transcriptasa inversa. Previene que el virus de la hepatitis B (VHB) se multiplique y reduce la cantidad de virus en el cuerpo.
entecavir
C12H15N5O3·H2O 295,29
6H-Purina-6-ona, 2-amino-1,9-dihidro-9-[(1S,3R,4S)-4-hidroxi-3-(hidroximetil)-2-metilenciclopentilo]-, monohidrato;
9-[(1S,3R,4S)-4-Hidroxi-3-(hidroximetil)-2-metilenciclopentil]guanina monohidrato [209216-23-9]; UNII: 5968Y6H45M.
Anhidro 277,28
DEFINICIÓN
Entecavir es un monohidrato y contiene no menos de 98% y no más de 102% de entecavir (C12H15N5O3), calculado en base anhidra.
IDENTIFICACIÓN
Cambiar para leer:
• A. PRUEBAS DE IDENTIFICACIÓN ESPECTROSCÓPICA<197>, Espectroscopia Infrarroja: 197A o 197K (CN 1-May-2020)
• B. El tiempo de retención del pico principal de la Solución muestra corresponde al de la Solución estándar, tal como se obtiene en la Valoración.
ENSAYO
• PROCEDIMIENTO
Solución A: Acetonitrilo y agua (3:97)
Solución B: Acetonitrilo
Fase móvil: Ver Tabla 1. [NOTA- Los tiempos de elución en gradiente se establecen en un sistema HPLC con un volumen de permanencia de aproximadamente 1,0 ml.]
Tabla 1 Tiempo (min) Solución A (%) Solución B (%)
0 100 0
8 100 0
50 77 23
75 17 83
90 100 0
100 100 0
Solución madre de idoneidad del sistema: 1,0 mg/mL de ER Mezcla de idoneidad del sistema Entecavir USP en metanol
Solución de idoneidad del sistema: 0,2 mg/mL de ER Mezcla de idoneidad del sistema Entecavir USP en Solución A de la solución madre de idoneidad del sistema
Solución madre estándar: 1,0 mg/mL de ER Monohidrato de Entecavir USP en metanol. Sonicar según sea necesario.
Solución estándar: 0,2 mg/mL de ER Entecavir Monohidrato USP en Solución A de la Solución madre del estándar
Solución madre de muestra: 1,0 mg/mL de Entecavir en metanol. Sonicar según sea necesario.
Solución muestra: 0,2 mg/mL de Entecavir en Solución A de Solución madre de muestra
sistema cromatográfico
(Consulte Cromatografía<621>, Idoneidad del sistema).
Modo: LC
Detector: UV 254 nm
Columna: 4,6-mm × 25-cm; 5-μm empaquetadura L1
Caudal: 1 ml/min
Volumen de inyección: 10 µL
Idoneidad del sistema
Muestras: Solución de idoneidad del sistema y Solución estándar
[ NOTA- Consulte la Tabla 2 para conocer los tiempos de retención relativos de los componentes en la solución de idoneidad del sistema.]
Requisitos de idoneidad
Resolución: No menos de 3,5 entre entecavir 1-epímero y entecavir; No menos de 2,0 entre entecavir y 8-hidroxi entecavir, Sistema
solución de idoneidad
Factor de cola: 0,8-1,5 para entecavir, solución de idoneidad del sistema
Desviación estándar relativa: No más de 1,5%, Solución estándar
Análisis
Muestras: Solución estándar y Solución muestra
Calcule el porcentaje de entecavir (C12H15N5O3) en la porción de entecavir tomada:
Resultado = (ru /rs ) × (Cs /Cu ) × 100
ru = respuesta máxima de entecavir de la Solución muestra
rs = respuesta máxima de entecavir de la Solución estándar
Cs = concentración de ER Entecavir Monohidrato USP en la Solución estándar (mg/mL)
Cu = concentración de Entecavir en la Solución muestra (mg/mL)
Criterios de aceptación: 98%-102% en base anhidra
IMPUREZAS
• IMPUREZAS ORGÁNICAS
Solución A, Solución B, Fase móvil, Solución madre de idoneidad del sistema, Solución madre de idoneidad del sistema, Solución madre de muestra, Solución muestra y Sistema cromatográfico: Proceder según se indica en la Valoración.
Solución madre estándar: Utilice la Solución estándar del Análisis.
Solución estándar: 0,2 µg/mL de ER Entecavir Monohidrato USP en Solución A de la Solución madre del estándar
Idoneidad del sistema
Muestras: Solución de idoneidad del sistema y Solución estándar
[ NOTA- Consulte la Tabla 2 para conocer los tiempos de retención relativos de los componentes en la solución de idoneidad del sistema.]
Requisitos de idoneidad
Resolución: No menos de 3,5 entre entecavir 1-epímero y entecavir; No menos de 2,0 entre entecavir y 8-hidroxi entecavir, Solución de idoneidad del sistema
Factor de cola: 0,8-1,5 para entecavir, solución de idoneidad del sistema
Desviación estándar relativa: No más de 10,0%, Solución estándar
Análisis
Muestras: Solución muestra y Solución estándar
Calcule el porcentaje de cada impureza en la porción de Entecavir tomada:
Resultado = (ru /rs ) × (Cs /Cu ) × (1/F) × 100
ru = respuesta máxima de cada impureza de la Solución muestra
rs = respuesta máxima de entecavir de la Solución estándar
Cs = concentración de ER Entecavir Monohidrato USP en la Solución estándar (mg/mL)
Cu = concentración de Entecavir en la Solución muestra (mg/mL)
F = factor de respuesta relativa (ver Tabla 2)
Criterios de aceptación: Consulte la Tabla 2. Ignore cualquier pico inferior al 0,05 %.
Tabla 2
Nombre Tiempo de retención relativo Factor de respuesta relativo Criterios de aceptación, no más (%)
Furoentecavir a 0,73 1,0 0,1
Entecavir 1-epímero b 0,93 1,0 0,1
Entecavir 3-epímero c 0,96 1,0 0,1
Entecavir 1.0 - -
8-Hidroxi entecavir d 1,03 0,67 0,1
Entecavir 4-epímero e 1,08 1,0 0,1
8-Metoxi entecavir f 1,27 0,67 0,1
4-Dimetilsilil entecavir g 1,84 1,0 0,1
Compuesto relacionado A de entecavir 3.41 - -
Cualquier impureza no especificada - 1,0 0,1
Impurezas totales i - - 0.3
a 9-[(3aS,4S,6S,6aR)-3a,6-Dihidroxihexahidro-1H-ciclopenta[c]furan-4-il]guanina.
b 9-[(1R,3R,4S)-4-Hidroxi-3-(hidroximetil)-2-metilenciclopentil]guanina.
c 9-[(1S,3S,4S)-4-Hidroxi-3-(hidroximetil)-2-metilenciclopentil]guanina.
d 8-Hidroxi-9-[(1S,3R,4S)-4-hidroxi-3-(hidroximetil)-2-metilenciclopentil]guanina.
e 9-[(1S,3R,4R)-4-Hidroxi-3-(hidroximetil)-2-metilenciclopentil]guanina.
f 8-Metoxi-9-[(1S,3R,4S)-4-hidroxi-3-(hidroximetil)-2-metilenciclopentil]guanina.
g 9-[(1S,3R,4S)-4-Hidroxidimetilsilil-3-(hidroximetil)-2-metilenciclopentil]guanina.
h Sólo para información; cuantificado en la prueba de límite del compuesto relacionado A de entecavir.
i Incluye la suma de todas las impurezas encontradas en las pruebas de Límite de Compuesto Relacionado A de Entecavir e Impurezas Orgánicas.
• LÍMITE DEL COMPUESTO A RELACIONADO DE ENTECAVIR
Solución A: 0,1% (v/v) de ácido trifluoroacético en agua
Solución B: ácido trifluoroacético al 0,1% (v/v) en acetonitrilo
Fase móvil: Ver Tabla 3. [ NOTA- Los tiempos de elución en gradiente se establecen en un sistema HPLC con un volumen de permanencia de
aproximadamente 1,0 ml.]
Tabla 3
Tiempo (min) Solución A (%) Solución B (%)
0 65 35
8 53 47
8.1 65 35
11 65 35
Solución estándar: 2 µg/mL de ER Compuesto Relacionado A de Entecavir USP en metanol
Solución muestra: 1,0 mg/mL de Entecavir en metanol. Sonicar según sea necesario.
sistema cromatográfico
(Consulte Cromatografía<621>, Idoneidad del sistema).
Modo: LC
Detector: UV 254 nm
Columna: 4,6-mm × 5-cm; 5-μm empaquetadura L1
Temperaturas
Muestreador automático: 4°
Columna: 30°
Caudal: 2 ml/min
Volumen de inyección: 10 µL
Idoneidad del sistema
Muestra: Solución estándar
Requisitos de idoneidad
Factor de cola: 0,8-1,5
Desviación estándar relativa: no más de 3,0%
Análisis
Muestras: Solución estándar y Solución muestra
Calcule el porcentaje del compuesto relacionado A de entecavir en la porción de entecavir tomada:
Resultado = (ru /rs ) × (Cs /Cu ) × 100
ru = respuesta máxima del compuesto relacionado A de entecavir de la Solución muestra
rs = respuesta máxima del compuesto relacionado A de entecavir de la Solución estándar
Cs = concentración de ER Compuesto Relacionado A de Entecavir USP en la Solución estándar (mg/mL)
Cu = concentración de Entecavir en la Solución muestra (mg/mL)
Criterios de aceptación: No más de 0,1%
PRUEBAS ESPECÍFICAS
• DETERMINACIÓN DEL AGUA<921>, Método I, Método Ic: 5,5%-7,0%
• ROTACIÓN ÓPTICA<781S>, Procedimientos, Rotación Específica
Solución muestra: 10 mg/mL de Entecavir en una mezcla de dimetilformamida y metanol (50:50)
Criterios de aceptación: +24° a +30°
REQUISITOS ADICIONALES
• ENVASADO Y ALMACENAMIENTO: Conservar en recipientes bien cerrados y protegidos de la luz. Conservar a temperatura ambiente.
• ESTÁNDARES DE REFERENCIA USP<11>
ER Entecavir Monohidrato USP
ER Compuesto Relacionado A de Entecavir USP
3-bencil-4-silil entecavir;
9-[(1S,3R,4S)-4-Dimetilfenilsilil-3-(benciloximetil)-2-metilenciclopentil]guanina.
C27H31N5O2Si 485,65
ER Mezcla de idoneidad del sistema Entecavir USP
La mezcla contiene monohidrato de entecavir y las siguientes impurezas (también pueden estar presentes otras impurezas):
Entecavir 1-epímero.
8-Hidroxi entecavir.
8-Metoxi entecavir.