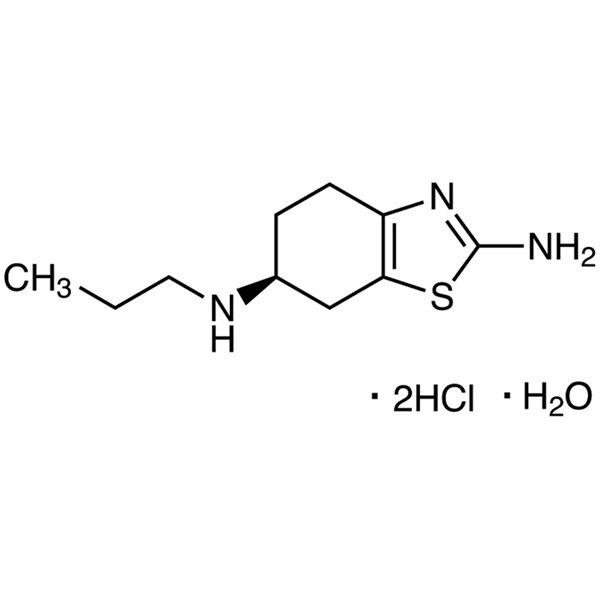
Pramipexol diclorhidrato monohidrato CAS 191217-81-9 Ensayo 98,0~102,0%
Ruifu Chemical es el fabricante líder de monohidrato de diclorhidrato de pramipexol (CAS: 191217-81-9) de alta calidad. Ruifu Chemical puede ofrecer entregas en todo el mundo, precios competitivos, excelente servicio y cantidades pequeñas y al por mayor disponibles. Compre monohidrato de diclorhidrato de pramipexol, Por favor contacte: alvin@ruifuchem.com
| Nombre químico | Monohidrato de diclorhidrato de pramipexol |
| Sinónimos | Pramipexol DiHCL monohidrato; Pramipexol 2HCl monohidrato; (S)-2-Amino-4,5,6,7-Tetrahidro-6-Dihidrocloruro de (propilamino)benzotiazol monohidrato |
| Estado del stock | En stock, producción comercial |
| Número CAS | 191217-81-9 |
| CAS relacionados | 104632-25-9 y 104632-26-0 |
| Fórmula molecular | C10H17N3S·2HCl·H2O |
| Peso Molecular | 302,26 g/mol |
| Punto de fusión | 290 ℃ (disminución) |
| Rotación específica [a]20/D | -65,0° a -71,0° (C=1 en MeOH) (calculado en base anhidra) |
| Solubilidad en agua | Soluble en agua |
| Solubilidad | Soluble en metanol. Muy ligeramente etanol. Insoluble en diclorometano |
| COA y MSDS | Disponible |
| Origen | Shanghái, China |
| Marca | Química Ruifu |
| Artículos | Especificaciones | Resultados |
| Apariencia | Blanco a blanquecino - Polvo cristalino | Cumple |
| Ensayo | 98,0~102,0% (calculado en base anhidra) | 99,8% |
| Agua de Karl Fischer | 4,5~6,5% | 4,9% |
| Residuo en el encendido | ≤0,10% | <0,10% |
| Metales pesados (Pb) | ≤10 ppm | <10 ppm |
| Sustancias relacionadas | ||
| Pramipexol Propionamida | ≤0,15% | Cumple |
| Compuesto relacionado A de pramipexol | ≤0,15% | Cumple |
| N-Propilpramipexol | ≤0,15% | Cumple |
| Dímero de pramipexol | ≤0,15% | Cumple |
| Cualquier otra impureza individual no identificada | ≤0,10% | Cumple |
| Pureza enantiomérica | ≤1,00% del compuesto relacionado D de pramipexol | Cumple |
| paladio | ≤5 ppm | <5 ppm |
| Espectro infrarrojo | Consistente con la estructura | Cumple |
| Conclusión | Ha sido probado y cumple con las especificaciones dadas. | |
Paquete: Botella de Fluorado, Bolsa de papel de aluminio, 25kg/Bidón de Cartón, o según requerimiento del cliente.

Condición de almacenamiento: Mantenga el recipiente bien cerrado y guárdelo en un lugar fresco, seco (2 ~ 8 ℃) y bien ventilado, lejos de sustancias incompatibles. Proteger de la luz y la humedad.
Envío:Entrega a todo el mundo por vía aérea, por FedEx / DHL Express. Proporcionar una entrega rápida y confiable.
C10H17N3S·2HCl·H2O 302,26
(S)-2-Amino-4,5,6,7-tetrahidro-6-(propilamino)benzotiazol diclorhidrato monohidrato [191217-81-9].
DEFINICIÓN
El diclorhidrato de pramipexol contiene no menos de 98,0% y no más de 102,0% de C10H19Cl2N3S, calculado en base anhidra.
IDENTIFICACIÓN
• A. Absorción de infrarrojos<197A>o<197M>
Rango de número de ondas:<197A>, 3800 cm-1 a 650 cm-1;<197M>, 4000 cm-1 a 600 cm-1
• B. El tiempo de retención del pico principal en la Solución muestra corresponde al de pramipexol (S-enantiómero) en la Solución de idoneidad del sistema en la prueba de Pureza Enantiomérica.
• C. Pruebas de identificación-General, Cloruro<191>
Muestra: 1 mg/mL de diclorhidrato de pramipexol en agua
Criterios de aceptación: Cumple con los requisitos de la prueba de precipitado de nitrato de plata.
ENSAYO
• Procedimiento
Solución A: Disolver 9,1 g de dihidrógenofosfato de potasio y 5,0 g de 1-octanosulfonato de sodio monohidrato en 1 litro de agua. Ajustar con ácido fosfórico a un pH de 3,0.
Solución B: Acetonitrilo y Solución A (1:1)
Diluyente: Acetonitrilo y Solución A (1:4)
Fase móvil: consulte la tabla de gradientes a continuación.
Tiempo (min) Solución A (%) Solución B (%)
0 60 40
15 20 80
15,1 60 40
20 60 40
Solución de idoneidad del sistema: 1,5 mg/mL de ER Dihidrocloruro de Pramipexol USP y 0,8 mg/mL de ER Compuesto Relacionado A de Pramipexol USP en Diluyente
Solución estándar: 1,5 mg/mL de ER Dihidrocloruro de Pramipexol USP en Diluyente
Solución muestra: 1,5 mg/mL de Dihidrocloruro de Pramipexol en Diluyente
sistema cromatográfico
(Consulte Cromatografía<621>, Idoneidad del sistema).
Modo: LC
Detector: UV 264 nm
Columna: 4,6-mm × 15-cm; 5-μm empaquetadura L1
Temperatura de la columna: 40 ± 5
Caudal: 1,5 ml/min
Tamaño de la inyección: 5 µL
Idoneidad del sistema
Muestras: Solución de idoneidad del sistema y Solución estándar [Nota-Los tiempos de retención relativos para el compuesto relacionado A de pramipexol y pramipexol son aproximadamente 0,7 y 1,0, respectivamente. ]
Requisitos de idoneidad
Resolución: No menos de 6,0 entre compuesto relacionado A de pramipexol y pramipexol, Solución de idoneidad del sistema
Factor de cola: NMT 2,0 para pramipexol, solución de idoneidad del sistema
Desviación estándar relativa: No más de 1,0%, Solución estándar
Análisis
Muestras: Solución estándar y Solución muestra
Calcule el porcentaje de C10H19Cl2N3S en la porción de diclorhidrato de pramipexol tomada:
Resultado = (rU/rS) × (CS/CU) × (Mr1/Mr2) × 100
rU = respuesta máxima de la Solución muestra
rS = respuesta máxima de la Solución estándar
CS = concentración de ER Dihidrocloruro de Pramipexol USP en la Solución estándar (mg/mL)
CU = concentración de la Solución muestra (mg/mL)
Mr1 = peso molecular del diclorhidrato de pramipexol, 284,26
Mr2 = peso molecular del diclorhidrato de pramipexol monohidrato, 302,26
Criterios de aceptación: 98,0%-102,0% en base anhidra
IMPUREZAS
Impurezas inorgánicas
• Residuo en la ignición<281>: No más de 0,10%
• Metales pesados, Método I<231>
Solución estándar: Solución estándar de plomo, 10 ppm
Solución muestra: Calcinar 2 g de Dihidrocloruro de Pramipexol hasta obtener una masa carbonizada casi seca. Enfriar el residuo, añadir 2,0 ml de ácido nítrico concentrado y 5 gotas de ácido sulfúrico concentrado y dejar que se desarrollen los vapores con cuidado. Encienda a 500-600 hasta que el carbón se haya quemado por completo. Enfriar el residuo, agregar 4 mL de ácido clorhídrico 6 M, tapar el crisol y digerir en baño maría hirviendo durante 15 min. Evaporar hasta sequedad. Añadir una gota de ácido clorhídrico concentrado y 10 ml de agua caliente y digerir durante 2 minutos más en baño maría hirviendo. Agregue gota a gota una solución de amoníaco 6 M hasta que la solución sea débilmente alcalina y ajústela con ácido acético 1 M a un pH de 3,0-4,0. Filtrar la solución en un matraz volumétrico de 25 ml y diluir con agua hasta 25 ml lavando el crisol y el filtro.
Criterios de aceptación: No más de 10 ppm
Impurezas Orgánicas
• Procedimiento
Solución A, Solución B, Diluyente, Fase móvil y Sistema cromatográfico: Proceder según se indica en el Ensayo.
Solución de idoneidad del sistema: 7,5 µg/mL de ER Dihidrocloruro de Pramipexol USP y 3 µg/mL de ER Compuesto Relacionado A de Pramipexol USP en Diluyente
Solución estándar: 1,5 µg/mL de ER Dihidrocloruro de Pramipexol USP en Diluyente
Solución muestra: 1,5 mg/mL de Dihidrocloruro de Pramipexol en Diluyente
Idoneidad del sistema
Muestras: Solución de idoneidad del sistema y Solución estándar
Requisitos de idoneidad
Resolución: No menos de 6,0 entre compuesto relacionado A de pramipexol y pramipexol, Solución de idoneidad del sistema
Factor de cola: NMT 2,0 para pramipexol, solución de idoneidad del sistema
Desviación estándar relativa: No más de 5,0%, Solución estándar
Análisis
Muestras: Solución estándar y Solución muestra
Calcule el porcentaje de cualquier impureza individual en la porción de diclorhidrato de pramipexol tomada:
Resultado = (rU/rS) × (CS/CU) × (Mr1/Mr2) × 100
rU = respuesta máxima de cada impureza de la Solución muestra
rS = respuesta máxima de pramipexol de la Solución estándar
CS = concentración de ER Dihidrocloruro de Pramipexol USP en la Solución estándar (mg/mL)
CU = concentración de diclorhidrato de pramipexol monohidrato en la Solución muestra (mg/mL)
Mr1 = peso molecular del diclorhidrato de pramipexol, 284,26
Mr2 = peso molecular del diclorhidrato de pramipexol monohidrato, 302,26
Criterios de aceptación
Impurezas individuales: consulte la Tabla de impurezas 1.
Impurezas totales: no más de 0,5%
Tabla de impurezas 1
Nombre Tiempo de retención relativo Criterios de aceptación, no más de 100 (%)
Pramipexol propionamida 0,5 0,15
Compuesto relacionado de pramipexol Ab 0,7 0,15
Pramipexol 1,0 —
N-Propilpramipexolec 1,4 0,15
Pramipexol dímero 1,7 0,15
Cualquier otra impureza individual no identificada: 0,10
a (S)-N-(2-Amino-4,5,6,7-tetrahidrobenzotiazol-6-il)propionamida.
b (S)-4,5,6,7-Tetrahidrobenzotiazol-2,6-diamina.
c (S)-2,6-Dipropilamino-4,5,6,7-tetrahidrobenzotiazol.
d N6,N6'-[2-Metilpentano-1,3-diil]bis(4,5,6,7-tetrahidrobenzotiazol-2,6-diamina). Se trata de un dímero de pramipexol (una mezcla de cuatro posibles isómeros).
PRUEBAS ESPECÍFICAS
• Determinación de agua, Método I<921>: No menos de 4,5% y No más de 6,5%.
• Pureza enantiomérica
Fase móvil: n-Hexano, alcohol deshidratado y dietilamina (850:150:1)
Solución madre de idoneidad del sistema: 1 mg/mL de ER Dihidrocloruro de Pramipexol USP y ER Compuesto Relacionado D de Pramipexol USP en alcohol deshidratado
Solución de idoneidad del sistema: 0,01 mg/mL de ER Dihidrocloruro de Pramipexol USP y ER Compuesto Relacionado D de Pramipexol USP de la solución madre de Idoneidad del sistema en fase móvil
Solución madre estándar: 2,0 mg/mL de ER Compuesto Relacionado D de Pramipexol USP en alcohol deshidratado
Solución estándar: 1,5 µg/mL de ER Compuesto Relacionado D de Pramipexol USP en fase móvil
Solución muestra: 0,3 mg/mL, preparada disolviendo una cantidad pesada adecuada de Dihidrocloruro de Pramipexol en un 25% del volumen de un matraz de alcohol deshidratado y diluyendo a volumen con Fase móvil
sistema cromatográfico
(Ver Cromatografía 621, Idoneidad del sistema).
Modo: LC
Detector: UV 254 nm
Columna: 4,6-mm × 25-cm; 10-μm empaquetadura L51
Caudal: 1,5 ml/min
Tamaño de muestra: 75 µL
Idoneidad del sistema
Muestras: Solución de idoneidad del sistema [Nota-Los tiempos de retención relativos para el compuesto relacionado D de pramipexol (R-enantiómero) y pramipexol (S-enantiómero) son 0,5 y 1,0, respectivamente. ]
Requisitos de idoneidad
Resolución: No menos de 5,0 entre el compuesto relacionado D de pramipexol y pramipexol, Solución de idoneidad del sistema
Factor de cola: NMT 2,4 para pramipexol, solución de idoneidad del sistema
Análisis
Muestras: Solución estándar y Solución muestra
Calcule el porcentaje del compuesto relacionado D de pramipexol en la porción de diclorhidrato de pramipexol tomada:
Resultado = (rU/rS) × (CS/CU) × 100
rU = respuesta máxima del compuesto relacionado D de pramipexol de la Solución muestra
rS = respuesta máxima del compuesto relacionado D de pramipexol de la Solución estándar
CS = concentración del compuesto relacionado D de pramipexol en la Solución estándar (mg/mL)
CU = concentración de la Solución muestra (mg/mL)
Criterios de aceptación: No más de 1,0% de compuesto relacionado D de pramipexol
• Límite de paladio
[Nota-Realice esta prueba si el paladio es una impureza inorgánica conocida. ]
Diluyente: ácido clorhídrico 0,1 M
Solución estándar: 40 µg/L de paladio en diluyente, a partir de una solución estándar de paladio disponible comercialmente para absorción atómica/plasma acoplado inductivamente. [Nota: prepare recientemente esta solución según sea necesario el día de su uso. ]
Solución muestra: A 0,5 g de Dihidrocloruro de Pramipexol en un matraz aforado de 50 ml, agregar 5,00 ml de ácido clorhídrico 1 M y disolver calentando. Enfriar a temperatura ambiente y diluir con agua a volumen.
Condiciones espectrométricas
(Ver Espectrofotometría y luz-Dispersión 851).
Modo: espectrofotometría de absorción atómica
Longitud de onda analítica: línea de emisión de paladio a 247,6 nm
Lámpara: Cátodo hueco
Fuente de atomización: Horno de grafito. [Nota: siga la secuencia de programación recomendada por el fabricante. ]
Tamaño de muestra: 20 µL
Blanco: Diluyente
Idoneidad del sistema
Muestra: Solución estándar
Requisitos de idoneidad
Absorbancia: No menos de 0,034
Análisis
Muestras: Solución estándar y Solución muestra
Determinar la concentración de paladio en la Solución muestra mediante el método de adición estándar.
Criterios de aceptación: No más de 5 ppm
REQUISITOS ADICIONALES
• Envasado y Almacenamiento: Conservar en recipientes bien cerrados, protegidos de la humedad y la luz.
• Estándares de referencia USP 11
ER Dihidrocloruro de Pramipexol USP Haga clic para ver la estructura
ER Compuesto Relacionado A Pramipexol USP
(S)-4,5,6,7-Tetrahidrobenzotiazol-2,6-diamina.
C7H11N3S 169,25
ER Compuesto Relacionado D Pramipexol USP
(R)-2-Amino-4,5,6,7-tetrahidro-6-(propilamino)benzotiazol.
C10H17N3S 211,33
¿Cómo comprar? Por favor contacteDr. Alvin Huang: sales@ruifuchem.com o alvin@ruifuchem.com
¿15 años de experiencia?Contamos con más de 15 años de experiencia en la fabricación y exportación de una amplia gama de productos químicos finos o intermedios farmacéuticos de alta calidad.
¿Principales mercados? Vender al mercado interno, América del Norte, Europa, India, Corea, Japón, Australia, etc.
¿Ventajas? Calidad superior, precio asequible, servicios profesionales y soporte técnico, entrega rápida.
Calidad Aseguramiento? Estricto sistema de control de calidad. Los equipos profesionales para análisis incluyen NMR, LC-MS, GC, HPLC, ICP-MS, UV, IR, OR, K.F, ROI, LOD, MP, claridad, solubilidad, prueba de límite microbiano, etc.
Muestras? La mayoría de los productos proporcionan muestras gratuitas para la evaluación de la calidad; el costo de envío debe ser pagado por los clientes.
Auditoría de fábrica? Bienvenida a la auditoría de fábrica. Por favor programe una cita con anticipación.
¿MOQ? Sin cantidad mínima de pedido. Se aceptan pedidos pequeños.
Tiempo de entrega? Si hay stock, entrega en tres días garantizada.
Transporte? Por expreso (FedEx, DHL), por aire, por mar.
¿Documentos? Servicio posventa: se pueden proporcionar COA, MOA, ROS, MSDS, etc.
Síntesis personalizada? Puede proporcionar servicios de síntesis personalizados que se adapten mejor a sus necesidades de investigación.
Condiciones de pago? La factura proforma se enviará primero después de la confirmación del pedido, adjuntando nuestros datos bancarios. Pago por T/T (Transferencia Télex), PayPal, Western Union, etc.
| WGK Alemania | 3 |
| RTECS | DL3375000 |
| Código HS | 2934 2000,90 |
Pramipexol diclorhidrato monohidrato (CAS: 191217-81-9) es un antihistamínico. Se utiliza principalmente clínicamente para tratar la enfermedad de Parkinson y su síndrome. Puede usarse solo o en combinación con Levodopa. El monohidrato de diclorhidrato de pramipexol es un agonista selectivo del receptor de dopamina tipo D2 que penetra la barrera hematoencefálica (BBB), con Kis de 2,2 nM, 3,9 nM, 0,5 nM y 1,3 nM para el receptor tipo D2, los receptores D2, D3 y D4, respectivamente. El hidrato de dihidrocloruro de pramipexol se puede utilizar para la investigación de la enfermedad de Parkinson (EP) y el síndrome de piernas inquietas (SPI).
1. Pramipexol se usa solo o con otros medicamentos para tratar la enfermedad de Parkinson. Puede mejorar su capacidad para moverse y disminuir los temblores, la rigidez, la lentitud de los movimientos y la inestabilidad. También puede disminuir el número de episodios de incapacidad para moverse ("síndrome on-off").
2. El pramipexol también se usa para tratar cierta afección médica (síndrome de piernas inquietas - SPI) que provoca una necesidad inusual de mover las piernas. Los síntomas suelen aparecer por la noche junto con sensaciones incómodas/desagradables en las piernas. Este medicamento puede disminuir estos síntomas y así mejorar el sueño.