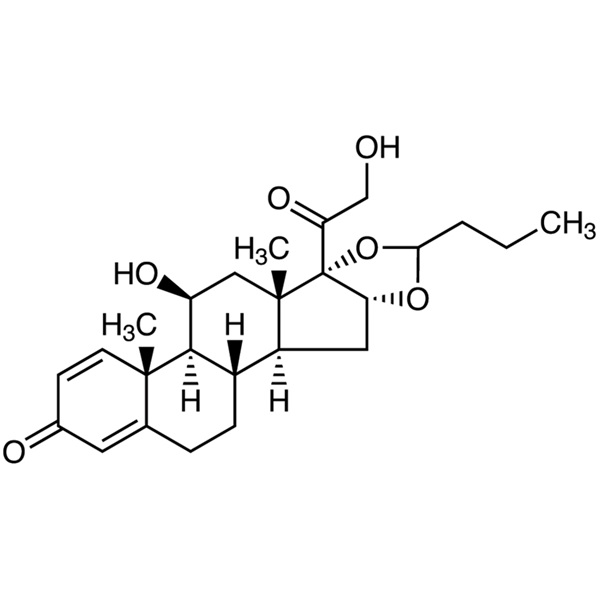
Budesonida CAS 51333-22-3 Ensayo 98,0~102,0%
Shanghai Ruifu Chemical Co., Ltd. es el fabricante líder de budesonida (CAS: 51333-22-3) de alta calidad. Ruifu Chemical puede ofrecer entregas en todo el mundo, precios competitivos, excelente servicio y cantidades pequeñas y al por mayor disponibles. comprar budesonida, Por favor contacte: alvin@ruifuchem.com
| Nombre químico | Budesonida |
| Sinónimos | (+)-16α,17α-Butilidendioxi-11β,21-Dihidroxi-1,4-Pregnadieno-3,20-Diona; 16,17-Butilidenbis(oxi)-11,21-Dihidroxipregna-1,4-Dieno-3,20-Diona; Rinocorto; Pulmicort; Entocort; simbicort |
| Estado del stock | En stock, producción comercial |
| Número CAS | 51333-22-3 |
| Fórmula molecular | C25H34O6 |
| Peso Molecular | 430,54 g/mol |
| Punto de fusión | 221,0 ~ 232,0 ℃ |
| Solubilidad | Insoluble en agua. Soluble en cloroformo, metanol. Ligeramente soluble en etanol, acetona. Muy ligeramente soluble en diclorometano y éter |
| COA y MSDS | Disponible |
| Origen del producto | Shanghái, China |
| Categorías de productos | API (ingrediente farmacéutico activo) |
| Precaución | No destinado al uso humano. Sólo para uso en investigación. |
| Marca | Química Ruifu |
| Artículos | Especificaciones | Resultados |
| Apariencia | Blanco a blanquecino - Polvo cristalino | Polvo cristalino blanco |
| Ensayo de budesonida | 98,0~102,0% | 98,7% |
| Pérdida por secado | <0,30% | 0,19% |
| Cualquier impureza | <0,20% | <0,20% |
| Epímero A | 40,0~51,0% | 47,29% |
| Metanol | <0,10% | 0,005% |
| Espectro infrarrojo | Consistente con la estructura | Cumple |
| Espectro de RMN 1H | Consistente con la estructura | Cumple |
| Conclusión | El producto ha sido probado y cumple con las especificaciones dadas. | |
Paquete: Botella, bolsa de papel de aluminio, tambor de cartón de 25 kg o según los requisitos del cliente.
Condición de almacenamiento: Mantener el recipiente bien cerrado. Almacenar en un lugar fresco, seco (2~8 ℃) y bien ventilado, lejos de sustancias incompatibles. Mantener alejado de la luz del sol; evitar el fuego y las fuentes de calor; evitar la humedad.
Envío:Entrega a todo el mundo por vía aérea, por FedEx / DHL Express. Proporcionar una entrega rápida y confiable.
Budesonida
C25H34O6 430,53
Pregna-1,4-dieno-3,20-diona, 16,17-[1R-butilidenbis(oxi)]-11,21-dihidroxi y pregna-1,4-dieno-3,20-diona,16,17-[1S-butilidenbis(oxi)]-11,21-dihidroxi;
(RS)-11,16,17,21-Tetrahidroxipregna-1,4-dieno-3,20-diona 16,17-acetal cíclico con butiraldehído [51372-29-3; 51372-28-2; 51333-22-3].
DEFINICIÓN
Cambiar para leer:
La budesonida es una mezcla de dos formas epiméricas, el epímero A(C-22S) y el epímero B(C-22R). Contiene no menos de 40,0% (RB 1-jun-2011) y no más de 51,0% de epímero A, y la suma de ambos epímeros es no menos de 98,0% y no más de 102,0% de C25H34O6, calculado sobre la base seca.
[Nota-Proteja de la luz todas las soluciones que contengan budesonida.]
IDENTIFICACIÓN
• A. Absorción de infrarrojos<197K>
• B. Absorción ultravioleta<197U>
Solución de muestra: 25 µg/mL
Medio: Metanol
Criterios de aceptación: Cumple los requisitos
ENSAYO
Cambiar para leer:
• Procedimiento
Tampón: 3,17 mg/mL de fosfato monobásico de sodio y 0,23 mg/mL de ácido fosfórico. El pH es 3,2 ± 0,1.
Fase móvil: Acetonitrilo y Tampón (32:68)
Solución estándar: Disolver una cantidad de Budesonida RS USP en acetonitrilo y diluir cuantitativamente con Tampón para obtener una solución que tenga una concentración de 0,5 mg/mL, manteniendo la proporción de acetonitrilo en esta solución a no más de 30%.
Solución muestra: Disolver 25 mg de Budesonida en 15 mL de acetonitrilo en un matraz aforado de 50 -mL y diluir a volumen con Tampón.
sistema cromatográfico
(Consulte Cromatografía<621>, Idoneidad del sistema).
Modo: LC
Detector: UV 254 nm
Columna: 4,6-mm × 15-cm; 5-μm empaquetadura L1
Caudal: 1,5 ml/min
Tamaño de la inyección: 20 µL
Idoneidad del sistema
Muestra: Solución estándar
[Nota-El tiempo de retención relativo del epímero A es 1,1, con respecto al epímero B.]
Requisitos de idoneidad
Resolución: No menos de 1,5 entre los dos picos del epímero de budesonida
Eficiencia de la columna: placas teóricas no menos de 5500, determinada a partir del pico del epímero B de budesonida
Análisis
Muestras: Solución estándar y Solución muestra
Calcule el porcentaje de epímero A (C25H34O6) en la porción de budesonida tomada:
Resultado = [rUA/(rUA + rUB)] × 100
rUA = área del pico del epímero A de la Solución muestra
rUB = área del pico del epímero B de la Solución muestra
Calcule el porcentaje de C25H34O6 en la porción de budesonida tomada:
Resultado = [(rUA + rUB)/(rSA + rSB)] × (CS/CU) × 100
rUA = área del pico del epímero A de la Solución muestra
rUB = área del pico del epímero B de la Solución muestra
rSA = área del pico del epímero A de la Solución estándar
rSB = área del pico del epímero B de la Solución estándar
CS = concentración de ER Budesonida USP en la Solución estándar (mg/mL)
CU = concentración de Budesonida en la Solución muestra (mg/mL)
Criterios de aceptación
Epimer A: 40,0% (RB 1-Jun-2011)-51,0% en base seca
Ambos epímeros: 98,0%-102,0% en base seca
IMPUREZAS
• Procedimiento 1: Límite de 21-Acetato de Budesonida
Tampón: 3,17 mg/mL de fosfato monobásico de sodio y 0,23 mg/mL de ácido fosfórico. El pH es 3,2 ± 0,1.
Fase móvil: Acetonitrilo y Tampón (45:55)
Solución estándar: Disolver una cantidad de Budesonida RS USP en acetonitrilo y diluir cuantitativamente con Tampón para obtener una solución que tenga una concentración de 0,5 mg/mL, manteniendo la proporción de acetonitrilo en esta solución a no más de 30%.
Solución muestra: Disolver 25 mg de Budesonida en 15 mL de acetonitrilo en un matraz aforado de 50 -mL y diluir a volumen con Tampón.
sistema cromatográfico
(Consulte Cromatografía<621>, Idoneidad del sistema).
Modo: LC
Detector: UV 254 nm
Columna: 4,6-mm × 15-cm; 5-μm empaquetadura L1
Caudal: 1,5 ml/min
Tamaño de la inyección: 20 µL
Idoneidad del sistema
Muestra: Solución estándar
[Nota-Los tiempos de retención relativos para el primer epímero eluido del 21-acetato de budesonida, el segundo epímero eluido del 21-acetato de budesonida, el primer epímero eluido de budesonida (epímero B) y el segundo epímero eluido de budesonida (epímero A) son 3,1, 3,2, 1,0 y 1,1, respectivamente. ]
Requisitos de idoneidad
Eficiencia de la columna: placas teóricas no menos de 5500, determinada a partir del pico del epímero B de budesonida
Análisis
Muestra: Solución de muestra
Calcule el porcentaje de 21-acetato de budesonida en la porción de budesonida tomada:
Resultado = (rT1/rT2) × 100
rT1 = suma de las áreas de los picos de los dos epímeros del 21-acetato de budesonida
rT2 = suma de las áreas de los dos picos de budesonida
Criterios de aceptación: No se encuentra 0,10% del 21-acetato de budesonida.
• Procedimiento 2: Límite de 11-Ketobudesonida
Tampón: 3,17 mg/mL de fosfato monobásico de sodio y 0,23 mg/mL de ácido fosfórico. El pH es 3,2 ± 0,1.
Fase móvil: Acetonitrilo, isopropanol y Tampón (26:9:65)
Solución estándar: Disolver una cantidad de Budesonida RS USP en acetonitrilo y diluir cuantitativamente con Tampón para obtener una solución que tenga una concentración de 0,5 mg/mL, manteniendo la proporción de acetonitrilo en esta solución a no más de 30%.
Solución muestra: Disolver 25 mg de Budesonida en 15 mL de acetonitrilo en un matraz aforado de 50 -mL y diluir a volumen con Tampón.
sistema cromatográfico
(Consulte Cromatografía<621>, Idoneidad del sistema).
Modo: LC
Detector: UV 254 nm
Columna: 4,6-mm × 15-cm; 3,5-μm empaquetadura L1
Temperatura de la columna: 50
[Nota-Precaliente la fase móvil a 50.]
Caudal: 1,5 ml/min
Tamaño de la inyección: 20 µL
Idoneidad del sistema
Muestra: Solución estándar
[Nota-Los tiempos de retención relativos para los dos epímeros de 11-cetobudesonida son 0,73 y 0,78, respectivamente; los tiempos de retención relativos para 21-deshidrobudesonida, 14,15-deshidrobudesonida y el primer epímero eluido de budesonida (epímero B) son 0,68, 0,84 y 1,0, respectivamente.]
Requisitos de idoneidad
Eficiencia de la columna: placas teóricas no menos de 5500, determinada a partir del pico del epímero B de budesonida
Análisis
Muestra: Solución de muestra
Calcule el porcentaje de 11-cetobudesonida en la porción de budesonida tomada:
Resultado = (rT1/rT2) × 100
rT1 = suma de las áreas de los dos picos de cetobudesonida
rT2 = suma de las áreas de los dos picos de budesonida
Criterios de aceptación: No se encuentra 0,2% de 11-cetobudesonida.
• Procedimiento 3
Tampón: 3,17 mg/mL de fosfato monobásico de sodio y 0,23 mg/mL de ácido fosfórico. El pH es 3,2 ± 0,1.
Fase móvil: Acetonitrilo y Tampón (32:68)
Solución estándar: Disolver una cantidad de Budesonida RS USP en acetonitrilo y diluir cuantitativamente con Tampón para obtener una solución que tenga una concentración de 0,5 mg/mL, manteniendo la proporción de acetonitrilo en esta solución a no más de 30%.
Solución muestra: Disolver 25 mg de Budesonida en 15 mL de acetonitrilo en un matraz aforado de 50 -mL y diluir a volumen con Tampón.
sistema cromatográfico
(Consulte Cromatografía<621>, Idoneidad del sistema).
Modo: LC
Detector: UV 254 nm
Columna: 4,6-mm × 15-cm; 5-μm empaquetadura L1
Caudal: 1,5 ml/min
Tamaño de la inyección: 20 µL
Idoneidad del sistema
Muestra: Solución estándar
Requisitos de idoneidad
Eficiencia de la columna: placas teóricas no menos de 5500, determinada a partir del pico del epímero B de budesonida
Análisis
Muestra: Solución de muestra
Calcule el porcentaje de cada impureza en la porción de budesonida tomada:
Resultado = (rU/rT) × 100
rU = área del pico para cada impureza
rT = suma de las áreas de todos los picos
Criterios de aceptación: Ver Tabla 1.
Tabla 1 Nombre Tiempo de retención relativo Criterios de aceptación, no más de un mes (%)
16-Hidroxiprednisolona 0,11 0,2
d-Homobudesonideb 0,36 0,10
21-Deshidrobudesonida (epímeros)c 0,61; 0,66 0,07d
14,15-Dehidrobudesonida 0,86 0,10
Total de impurezas especificadas - 0.4f
Cualquier otra impureza individual - 0,10
Total de impurezas no especificadas - 0,4
una 11,16,17,21-Tetrahidroxipregna-1,4-dieno-3,20-diona.
b 16,17-[(1RS)-Butilidenbis(oxi)]-11-hidroxi-17-(hidroximetil)-d-homoandrosta-1,4-dieno-3,17a-diona.
c 16,17-[(1RS)-Butilidenbis(oxi)]-11-hidroxi-3,20-dioxopregna-1,4-dien-21-al.
d El límite incluye ambos epímeros.
e 16,17-[(1RS)-Butilidenbis(oxi)]-11,21-dihidroxipregna-1,4,14-trieno-3,20-diona.
f El total de impurezas especificadas incluye 11-cetobudesonida obtenida en la prueba de límite de 11-cetobudenósido y las impurezas enumeradas anteriormente.
PRUEBAS ESPECÍFICAS
• Pruebas de enumeración microbiana<61>y pruebas para microorganismos específicos<62>: el recuento microbiano aeróbico total es no más de 103 ufc/g, y el recuento total combinado de mohos y levaduras es no más de 102 ufc/g.
• Pérdida por secado<731>: Seque una muestra a 105ºC hasta obtener un peso constante: pierde no más de 0,3% de su peso.
REQUISITOS ADICIONALES
• Embalaje y almacenamiento: Conservar en recipientes herméticos y resistentes a la luz. Almacenar a temperatura ambiente controlada.
• Estándares de referencia USP<11>
Budesonida USP ER
¿Cómo comprar? Por favor contacteDr. Alvin Huang: sales@ruifuchem.com o alvin@ruifuchem.com
¿15 años de experiencia?Contamos con más de 15 años de experiencia en la fabricación y exportación de una amplia gama de productos químicos finos o intermedios farmacéuticos de alta calidad.
¿Principales mercados? Vender al mercado interno, América del Norte, Europa, India, Corea, Japón, Australia, etc.
¿Ventajas? Calidad superior, precio asequible, servicios profesionales y soporte técnico, entrega rápida.
Calidad Aseguramiento? Estricto sistema de control de calidad. Los equipos profesionales para análisis incluyen NMR, LC-MS, GC, HPLC, ICP-MS, UV, IR, OR, K.F, ROI, LOD, MP, claridad, solubilidad, prueba de límite microbiano, etc.
Muestras? La mayoría de los productos proporcionan muestras gratuitas para la evaluación de la calidad; el costo de envío debe ser pagado por los clientes.
Auditoría de fábrica? Bienvenida a la auditoría de fábrica. Por favor programe una cita con anticipación.
¿MOQ? Sin cantidad mínima de pedido. Se aceptan pedidos pequeños.
Tiempo de entrega? Si hay stock, entrega en tres días garantizada.
Transporte? Por expreso (FedEx, DHL), por aire, por mar.
¿Documentos? Servicio posventa: se pueden proporcionar COA, MOA, ROS, MSDS, etc.
Síntesis personalizada? Puede proporcionar servicios de síntesis personalizados que se adapten mejor a sus necesidades de investigación.
Condiciones de pago? La factura proforma se enviará primero después de la confirmación del pedido, adjuntando nuestros datos bancarios. Pago por T/T (Transferencia Télex), PayPal, Western Union, etc.
Símbolos de peligro Xn - Nocivo
Códigos de riesgo R40 - Evidencia limitada de un efecto cancerígeno.
R36/37/38 - Irrita los ojos, el sistema respiratorio y la piel.
R20/21/22 - Nocivo por inhalación, en contacto con la piel y por ingestión.
Descripción de seguridad S22 - No respirar el polvo.
S36 - Utilice ropa protectora adecuada.
S26 - En caso de contacto con los ojos, enjuagar inmediatamente con abundante agua y consultar a un médico.
WGK Alemania 3
RTECSTU3723000
Código SA 2937 2900,99
La budesonida (CAS: 51333-22-3) (nombre comercial: Pulmicort) es un medicamento corticosteroide sintético. La budesonida está indicada para el mantenimiento y tratamiento profiláctico del asma. También se utiliza para el tratamiento a largo plazo de la enfermedad pulmonar obstructiva crónica (EPOC). La budesonida también es útil para el tratamiento de la enfermedad inflamatoria intestinal, incluida la enfermedad de Crohn, la colitis ulcerosa y la colitis microscópica, y también para el tratamiento de la rinitis alérgica. La budesonida exhibe una potente actividad glucocorticoide y una débil actividad mineralocorticoide in vivo. Es eficaz para inhibir las actividades de múltiples tipos de células y mediadores que participan en la inflamación mediada por alergia o no alérgica.
La budesonida es un fármaco clínico de uso común en el tratamiento del asma bronquial en China. Puede usarse para el asma no dependiente de hormonas o dependiente de hormonas y para la bronquitis asmática crónica. O se usa para el tratamiento de la rinitis alérgica estacional y la rinitis alérgica que ocurre muchos años y se usa para prevenir la regeneración de pólipos después de la extirpación de los pólipos nasales.