Aciclovir CAS 59277-89-3 Ensayo 98.0-101.0% (HPLC) API Antiviral de fábrica de alta calidad
Shanghai Ruifu Chemical Co., Ltd. es el fabricante líder de aciclovir (CAS: 59277-89-3) de alta calidad, API, utilizado para tratar infecciones por HSV y VZV. Ruifu Chemical lleva más de 15 años suministrando API y productos intermedios farmacéuticos. Ruifu Chemical puede ofrecer entregas en todo el mundo, precios competitivos y excelente servicio.
Comprar aciclovir u otros productos, por favor envíe un correo electrónico: alvin@ruifuchem.com
| Nombre químico | aciclovir |
| Sinónimos | vinagre de manzana; acicloguanosina; 9-[(2-Hidroxietoxi)metil]guanina; aciclovir |
| Número CAS | 59277-89-3 |
| Estado del stock | En stock, la producción aumentará hasta cientos de kilogramos |
| Fórmula molecular | C8H11N5O3 |
| Peso Molecular | 225,2 |
| Punto de fusión | 256,0 ~ 257,0 ℃ |
| COA y MSDS | Disponible |
| Origen del producto | Shanghái, China |
| Categorías de productos | API (ingrediente farmacéutico activo) |
| Marca | Química Ruifu |
| Artículo | Especificaciones | Resultados |
| Apariencia | Polvo cristalino blanco | Cumple |
| Absorción infrarroja | Positivo | Cumple |
| Tiempo de retención (HPLC) | Positivo | Cumple |
| Contenido de agua (por K.F) | ≤6,00% | 5,20% |
| Impurezas ordinarias (TLC) | ≤1,00% | <1,00% |
| Límite de guanina (HPLC) | ≤0,70% | 0,18% |
| Metales pesados | ≤20 ppm | Cumple |
| Método de ensayo/análisis | 98,0%-101,0% (calculado en base anhidra) | 99,20% |
| Conclusión | El producto ha sido probado y cumple con la norma USP35. | |
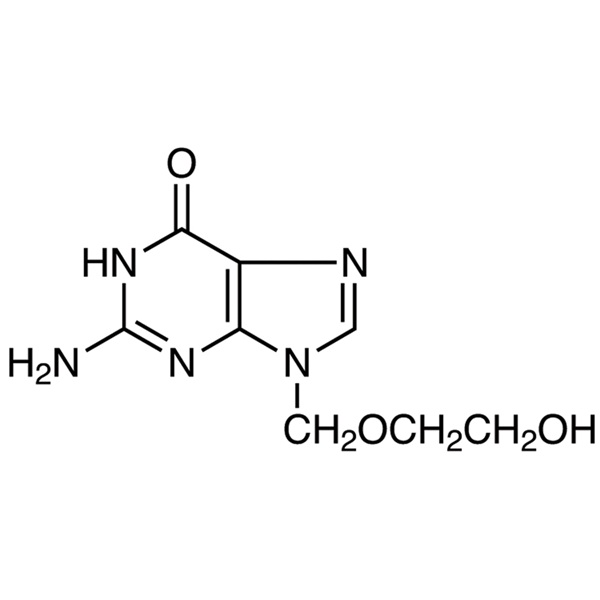
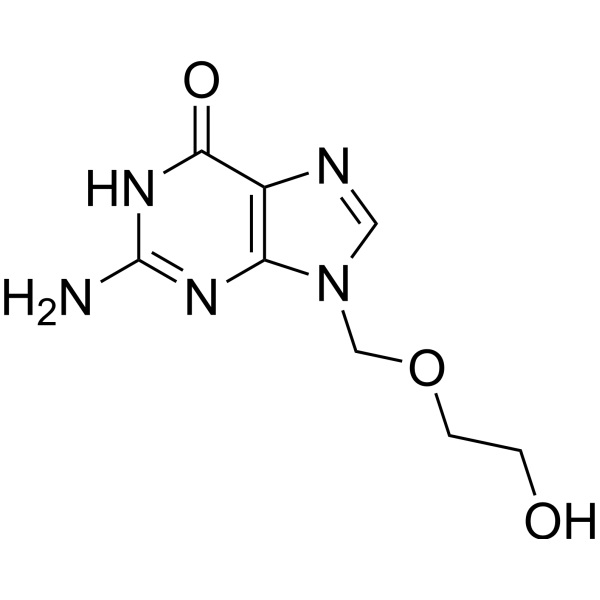
aciclovir
C8H11N5O3 225,20
6H-Purina-6-ona, 2-amino-1,9-dihidro-9-[(2-hidroxietoxi)metil]-.
9-[(2-Hidroxietoxi)metil]guanina [59277-89-3].
» El aciclovir contiene no menos del 98,0 por ciento y no más del 101,0 por ciento de C8H11N5O3, calculado en base anhidra.
Embalaje y almacenamiento- Conservar en recipientes herméticos. Conservar a temperatura ambiente. Proteger de la luz y la humedad.
Estándares de referencia USP<11>-
ER Aciclovir USP -
Identificación-
R: Absorción de infrarrojos <197K>.
B: El tiempo de retención del pico principal en el cromatograma de la Preparación de ensayo corresponde al cromatograma de la Preparación estándar, tal como se obtiene en el Ensayo y límite para la guanina.
Agua, Método I<921>: no más del 6,0%.
Impurezas ordinarias<466>-
Solución de prueba: dimetilsulfóxido.
Solución estándar: dimetilsulfóxido.
Eluyente: una mezcla de cloroformo, metanol e hidróxido de amonio (80:20:2).
Visualización: 1.
Volumen de aplicación: 5 µL.
Límite: 1%.
Ensayo y límite de guanina-
Fase móvil- Preparar una solución filtrada y desgasificada de ácido acético glacial en agua (1 en 1000). Realice ajustes si es necesario (consulte Idoneidad del sistema en Cromatografía<621>).
Solución de idoneidad del sistema 1- Disolver cantidades pesadas con precisión de ER Aciclovir USP y guanina en hidróxido de sodio 0,1 N y diluir cuantitativamente, y gradualmente si es necesario, con agua para obtener una solución que tenga concentraciones conocidas de aproximadamente 0,1 mg de cada uno por ml.
Solución de idoneidad del sistema 2- Disolver una cantidad de guanina pesada con precisión en hidróxido de sodio 0,1 N y diluir cuantitativamente, y gradualmente si es necesario, con agua para obtener una solución que tenga una concentración conocida de aproximadamente 0,7 µg por ml.
Preparación estándar de guanina- Transfiera aproximadamente 8,75 mg de guanina, pesados con precisión, a un matraz volumétrico de 500 ml. Disolver en 50 ml de hidróxido de sodio 0,1 N, diluir a volumen con agua y mezclar. Transferir 2,0 ml de esta solución a un matraz volumétrico de 50 ml, diluir a volumen con hidróxido de sodio 0,01 N y mezclar para obtener una solución que tenga una concentración de aproximadamente 0,7 µg por ml.
Preparación estándar- Disolver aproximadamente 25 mg de ER Aciclovir USP, pesados con precisión, en 5 ml de hidróxido de sodio 0,1 N en un matraz volumétrico de 50 ml, diluir a volumen con agua y mezclar. Transfiera 10,0 ml de esta solución a un matraz volumétrico de 50 ml, diluya a volumen con hidróxido de sodio 0,01 N y mezcle para obtener una solución que tenga una concentración conocida de aproximadamente 0,1 mg de ER Aciclovir USP por ml.
Preparación del ensayo- Disolver unos 100 mg de aciclovir, pesados con precisión, en 20 ml de hidróxido de sodio 0,1 N en un matraz aforado de 200 ml, diluir a volumen con agua y mezclar. Transferir 10,0 ml de esta solución a un matraz aforado de 50 ml, diluir a volumen con hidróxido de sodio 0,01 N y mezclar.
Sistema cromatográfico (ver Cromatografía<621>)- El cromatógrafo líquido está equipado con un detector de 254 nm y una columna de 4,6 mm × 25 cm que contiene el relleno L1. El caudal es de aproximadamente 3 ml por minuto. Cromatógrafo Solución de idoneidad del sistema 1 y registre las respuestas de los picos según se indica en el Procedimiento: la resolución, R, entre aciclovir y guanina no es inferior a 2,0; el factor de cola para el pico del analito no es superior a 2; y la desviación estándar relativa para inyecciones repetidas para el pico de aciclovir no es superior al 2,0%. Solución de idoneidad del sistema de cromatografía 2 y registre las respuestas de los picos según se indica en el Procedimiento: la desviación estándar relativa para inyecciones repetidas no es superior al 2,0 %.
Procedimiento- Inyecte por separado volúmenes iguales (aproximadamente 20 µL) de la preparación estándar, la preparación estándar de guanina y la preparación de ensayo en el cromatógrafo, registre los cromatogramas y mida las respuestas de todos los picos. Calcular la cantidad, en µg, de guanina en la porción de Aciclovir tomada mediante la fórmula:
1000C(ru/rS)
en la que C es la concentración, en µg por ml, de guanina en la preparación estándar de guanina; y rU y rS son las respuestas máximas debidas a la guanina en la preparación de ensayo y en la preparación estándar de guanina, respectivamente: no se encuentra más del 0,7% de guanina. Calcule la cantidad, en mg, de C8H11N5O3 en la porción de Aciclovir tomada mediante la fórmula:
1000C(ru/rS)
en la que C es la concentración, en mg por ml, de ER Aciclovir USP en la Preparación estándar; y rU y rS son las respuestas máximas debidas al aciclovir en la Preparación de ensayo y la Preparación estándar, respectivamente.
Paquete: Botella, bolsa de papel de aluminio, 25 kg/tambor de cartón, o según requerimiento del cliente.
Condición de almacenamiento: Mantener el recipiente bien cerrado y almacenar en un lugar fresco, seco y bien ventilado, lejos de sustancias incompatibles. Mantener alejado de la luz del sol; evitar el fuego y las fuentes de calor; evitar la humedad.
Envío: Entrega a todo el mundo por vía aérea, por FedEx / DHL Express. Proporcionar una entrega rápida y confiable.

Códigos de riesgo R36/37/38 - Irrita los ojos, el sistema respiratorio y la piel.
R40 - Evidencia limitada de un efecto cancerígeno.
R20/21/22 - Nocivo por inhalación, en contacto con la piel y por ingestión.
Descripción de seguridad S22 - No respirar el polvo.
S24/25 - Evite el contacto con la piel y los ojos.
S36 - Utilice ropa protectora adecuada.
S26 - En caso de contacto con los ojos, enjuagar inmediatamente con abundante agua y consultar a un médico.
S23 - No respirar el vapor.
WGK Alemania 2
RTECS UP0791400
Código SA 2933990099
Clase de peligro IRRITANTE
El aciclovir (ACV, CAS 59277-89-3), también conocido como acicloguanosina, es un medicamento antiviral. Se utiliza principalmente para el tratamiento de infecciones por herpes simple, varicela y culebrilla. Otros usos incluyen la prevención de infecciones por citomegalovirus después de un trasplante y complicaciones graves de la infección por el virus de Epstein-Barr. Puede tomarse por vía oral, aplicarse en forma de crema o inyectarse. El aciclovir se usa para tratar infecciones por HSV y VZV. El aciclovir es un análogo de purina sintético derivado de la guanina. Ejerce sus efectos sobre el virus del herpes simple (HSV) y el virus de la varicela zóster al interferir con la síntesis de ADN mediante la fosforilación por la timidina quinasa viral y la posterior inhibición de la ADN polimerasa viral, inhibiendo así la replicación viral. El aciclovir fue patentado en 1974 y aprobado para uso médico en 1981. Está en la Lista de medicamentos esenciales de la Organización Mundial de la Salud. Está disponible como medicamento genérico y se comercializa con muchas marcas en todo el mundo.